早教吧作业答案频道 -->化学-->
磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4•2H2O.(1)CaSO4•2H2O脱水反应相关的热化学方程式为:CaSO4•2H2O(s)═CaSO4•12H2O(s)+32H2O
题目详情
磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4•2H2O.
(1)CaSO4•2H2O脱水反应相关的热化学方程式为:
CaSO4•2H2O(s)═CaSO4•
H2O(s)+
H2O(g)△H1=83.2kJ•mol-1
CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
H2O(g)=H2O(l)△H3=-44kJ•mol-1
则反应CaSO4•
H2O(s)═CaSO4(s)+
H2O(g)的△H4=___kJ•mol-1.
(2)用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.
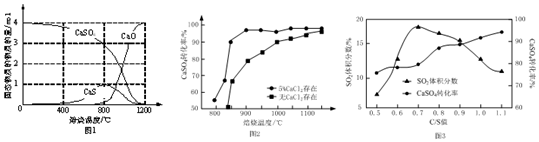
①以CO作还原剂,改变反应温度可得到不同的产物.不同温度下反应后所得固体成分的物质的量如图1所示.在低于800℃时主要还原产物为___;高于800℃时主要发生的反应的化学方程式为___.
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如图2所示.CaCl2的作用是___;当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___.
③以C作还原剂,向密闭容器中加入相同质量的几组不同
值(炭粉与CaSO4的物质的量之比)的混合物在1100℃加热,结果如图3所示.当
值为0.5时,反应产物为CaO、SO2和CO2;当
值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是___.
(3)已知Ksp(CaSO4)=7.10×10-5,Ksp(CaCO3)=6.2125×10-7,利用反应CaSO4(s)+(NH4)2CO3(aq)⇌CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵.若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,此时溶液中c(CO32-)=___.
(1)CaSO4•2H2O脱水反应相关的热化学方程式为:
CaSO4•2H2O(s)═CaSO4•
| 1 |
| 2 |
| 3 |
| 2 |
CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
H2O(g)=H2O(l)△H3=-44kJ•mol-1
则反应CaSO4•
| 1 |
| 2 |
| 1 |
| 2 |
(2)用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.

①以CO作还原剂,改变反应温度可得到不同的产物.不同温度下反应后所得固体成分的物质的量如图1所示.在低于800℃时主要还原产物为___;高于800℃时主要发生的反应的化学方程式为___.
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如图2所示.CaCl2的作用是___;当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___.
③以C作还原剂,向密闭容器中加入相同质量的几组不同
| C |
| S |
| C |
| S |
| C |
| S |
(3)已知Ksp(CaSO4)=7.10×10-5,Ksp(CaCO3)=6.2125×10-7,利用反应CaSO4(s)+(NH4)2CO3(aq)⇌CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵.若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,此时溶液中c(CO32-)=___.
▼优质解答
答案和解析
(1)已知①CaSO4•2H2O(s)═CaSO4•
H2O(s)+
H2O(g)△H1=83.2kJ•mol-1
②CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
将②-③×2-①得CaSO4•
H2O(s)═CaSO4(s)+
H2O(g),则△H4=[26kJ•mol-1-(-44kJ•mol-1)×2-83.2kJ•mol-1]=30.8kJ•mol-1,
故答案为:30.8;
(2)①从图示1可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4
4CaO+4SO2↑,氧化钙的物质的量增加,硫化钙的物质的量减小,
故答案为:CaS;CaS+3CaSO4
4CaO+4SO2↑;
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动;
③当
值大于0.7时,高温下,过量的C与CO2反应生成CO气体,反应产物为CaO、SO2和CO2、CO,使气体总体积增大,也可能硫酸钙部分转化为其他含硫物质,
故答案为:高温下,过量的C与CO2反应生成CO,使气体总体积增大(或部分转化为其他含硫物质);
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)⇌SO42-(aq)+CaCO3(s),若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,已知Ksp(CaSO4)=c(Ca2+)×c(SO42-)=7.10×10-5,c(Ca2+)=3.55×10-5mol•L-1,Ksp(CaCO3)=6.2125×10-7,Ksp(CaCO3)=c(Ca2+)×c(CO32-),c(CO32-)=1.75×10-2 mol•L-1,
故答案为:1.75×10-2 mol•L-1.
| 1 |
| 2 |
| 3 |
| 2 |
②CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
将②-③×2-①得CaSO4•
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:30.8;
(2)①从图示1可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4
| ||
故答案为:CaS;CaS+3CaSO4
| ||
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动;
③当
| C |
| S |
故答案为:高温下,过量的C与CO2反应生成CO,使气体总体积增大(或部分转化为其他含硫物质);
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)⇌SO42-(aq)+CaCO3(s),若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,已知Ksp(CaSO4)=c(Ca2+)×c(SO42-)=7.10×10-5,c(Ca2+)=3.55×10-5mol•L-1,Ksp(CaCO3)=6.2125×10-7,Ksp(CaCO3)=c(Ca2+)×c(CO32-),c(CO32-)=1.75×10-2 mol•L-1,
故答案为:1.75×10-2 mol•L-1.
看了 磷石膏是湿法生产磷酸排出的工...的网友还看了以下:
下列离子方程式书写正确的是()A.碳酸钙与盐酸反应:CO2−3+2H+═CO2↑+H2OB.碳酸钡 2020-04-09 …
下列关于铵盐的叙述1铵态氮肥中的氮元素都是-3价2铵盐易溶于水3铵盐能与碱反应,不能与酸反应4铵盐 2020-05-16 …
高中化学离子方程式问题1.碳酸氢钾与澄清石灰水反应2.亚硫酸钠溶液与稀硫酸反应3.硅与烧碱溶液反应 2020-05-16 …
1过氧化钠与盐酸反应2碳酸钠与足量的盐酸反应碳酸钠与少量的盐酸反应3碳酸氢钠与盐酸反应4碳酸氢钠与 2020-05-24 …
关于化学方程式及离子方程式的问题请写出下列的化学方程式及离子方程式1.饱和的氯化铁溶液滴入沸水中2 2020-06-05 …
按要求写化学方程式1.铜与稀硝酸反应2.铜与浓硝酸反应3.铜与浓硫酸反应4.铁与稀硝酸反应5.NaO 2021-02-13 …
跪求!下面几个化学反应方程式:1.单质铜与稀硝酸反应.2.氯气通入冷的氢氧化钠溶液中.3.亚硝酸钡与 2021-02-13 …
写出下列反应的离子方程式注意配平和符号1.铁与硝酸银溶液反应2.氧化铜和稀硫酸反应3.NaHCO3溶 2021-02-13 …
写出下列离子方程式1铁跟稀盐酸反应2铜跟硝酸银溶液反应3澄清石灰水跟硝酸反应4石灰乳跟盐酸反应5Ba 2021-02-13 …
初三下册化学方程式并指出反应的基本类型1.铁在空气中燃烧2.铁与稀盐酸反应3.铝与稀硫酸反应4.镁与 2021-02-18 …