早教吧作业答案频道 -->化学-->
工业上用辉铜矿(主要成分Cu2S,含Fe3O4、SiO2杂质)为原料,生产硫酸铜晶体的工艺流程如下:已知:①固体B为氧化物组成的混合物②[Cu(NH3)4]2+(aq)⇌Cu2+(aq)+4NH3(aq)(1)气体X是
题目详情
工业上用辉铜矿(主要成分Cu2S,含Fe3O4、SiO2杂质)为原料,生产硫酸铜晶体的工艺流程如下:
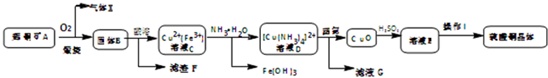
已知:①固体B为氧化物组成的混合物 ②[Cu(NH3)4]2+(aq)⇌Cu2+(aq)+4NH3(aq)
(1)气体X是___,高温下在过量空气中煅烧辉铜矿时,Cu2S发生反应的方程式为:___.
(2)固体B酸溶时加入稀硫酸和H2O2,目的是___,不用浓硫酸的原因是___.
(3)鉴别溶液D中Fe3+完全除尽的方法是___.滤液G的主要溶质是___(填化学式).
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、___、烘干.
(5)用“间接碘量法”测定所制备的CuSO4•5H2O(不含能与I-反应的氧化性杂质)的纯度.取a g试样配成100mL溶液,取25.00mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,滴加KI溶液至沉淀不再产生为止,然后用硫代硫酸钠标准溶液滴定生成的I2,发生反应的化学方程式为I2+2Na2S2O3═2NaI+Na2S4O6,消耗c mol•L-1 Na2S2O3溶液的体积为V mL.
①写出CuSO4与KI反应的离子方程式___.
②计算试样中CuSO4•5H2O的纯度___(用a、c、V表示).

已知:①固体B为氧化物组成的混合物 ②[Cu(NH3)4]2+(aq)⇌Cu2+(aq)+4NH3(aq)
(1)气体X是___,高温下在过量空气中煅烧辉铜矿时,Cu2S发生反应的方程式为:___.
(2)固体B酸溶时加入稀硫酸和H2O2,目的是___,不用浓硫酸的原因是___.
(3)鉴别溶液D中Fe3+完全除尽的方法是___.滤液G的主要溶质是___(填化学式).
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、___、烘干.
(5)用“间接碘量法”测定所制备的CuSO4•5H2O(不含能与I-反应的氧化性杂质)的纯度.取a g试样配成100mL溶液,取25.00mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,滴加KI溶液至沉淀不再产生为止,然后用硫代硫酸钠标准溶液滴定生成的I2,发生反应的化学方程式为I2+2Na2S2O3═2NaI+Na2S4O6,消耗c mol•L-1 Na2S2O3溶液的体积为V mL.
①写出CuSO4与KI反应的离子方程式___.
②计算试样中CuSO4•5H2O的纯度___(用a、c、V表示).
▼优质解答
答案和解析
辉铜矿通入氧气充分煅烧,生成二氧化硫气体和固体CuO、Fe3O4,加入盐酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,[Cu(NH3)4]2+经加热可得到CuO,加入硫酸得到硫酸铜溶液,经蒸发浓缩、冷却结晶后可得到硫酸铜晶体,
(1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫,方程式为:Cu2S+2O2
2CuO+SO2,所以气体X是SO2;
故答案为:SO2;Cu2S+2O2
2CuO+SO2;
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;因为浓硫酸氧化Fe2+反应会生成对环境有污染的SO2,所以不用,
故答案为:溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;浓硫酸与Fe2+反应会生成对环境有污染的SO2;
(3)因为三价铁与KSCN溶液出现血红色,所以取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;因为溶液D中含有[Cu(NH3)4]2+和硫酸根,所以D转化生成CuO后,剩余的溶液中含有(NH4)2SO4;
故答案为:取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;(NH4)2SO4;
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干,
故答案为:过滤、洗涤;
(5)①硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
②据比例关系4CuSO4•5H2O~4Cu2+~2I2~4S2O32-,
c×V×10-3mol c×V×10-3mol
试样中CuSO4•5H2O的质量分数为
×
×100%=
%,
故答案为:
%.
(1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫,方程式为:Cu2S+2O2
| ||
故答案为:SO2;Cu2S+2O2
| ||
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;因为浓硫酸氧化Fe2+反应会生成对环境有污染的SO2,所以不用,
故答案为:溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;浓硫酸与Fe2+反应会生成对环境有污染的SO2;
(3)因为三价铁与KSCN溶液出现血红色,所以取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;因为溶液D中含有[Cu(NH3)4]2+和硫酸根,所以D转化生成CuO后,剩余的溶液中含有(NH4)2SO4;
故答案为:取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;(NH4)2SO4;
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干,
故答案为:过滤、洗涤;
(5)①硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
②据比例关系4CuSO4•5H2O~4Cu2+~2I2~4S2O32-,
c×V×10-3mol c×V×10-3mol
试样中CuSO4•5H2O的质量分数为
| c×V×10&;-3×250 |
| a |
| 100mL |
| 25mL |
| 100cv |
| a |
故答案为:
| 100cv |
| a |
看了 工业上用辉铜矿(主要成分Cu...的网友还看了以下:
检验铵根离子的实验所依据的是(1)氨气易溶于水(2)铵根离子与OH-间发生反应产生氨气(3)NH3 2020-04-27 …
实验室模拟工业用NH3制硝酸,若用标准状况下11.2LNH3,理论上能生产多少克HNO3?这个“理 2020-04-27 …
非常急!帮我翻译成英语!1.接受良好的教育,能开拓我们的视野,让我们的生活更加充实2.如果要建设一 2020-05-15 …
注意:大工11春《大学英语3》在线作业3作业答案谁知道?一、单选题(共15道试题,共90分.)1. 2020-05-21 …
企业3月末的资产总额是200万元,4月1日发生下列三笔业务某企业3月末的资产总额为200万元,4月 2020-06-20 …
某企业去年净利润为1亿元,计划3年每年净利润增长10%,试求该企业3年后的净利润(精确到0.1.. 2020-07-14 …
1.星期一我们在班会上就""展开讨论2.60%同学认为高中毕业后应该上大学,因为上大学不仅可以增长 2020-08-03 …
经济学解答题,已知某完全竞争行业……1.已知某完全竞争行业中的单个厂商的短期成本函数为STC=2Q∧ 2020-11-06 …
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是(1)NO和NO2(2)NO2 2020-12-20 …
已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O.向含有等物质的量的NH4Cl、 2021-02-01 …