早教吧作业答案频道 -->化学-->
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产流程如下:(1)配制KOH溶液时,是在每100mL水中溶解61.6gKOH固体(该溶液的密度为1.47g/mL),它的物质的量
题目详情
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产流程如下:
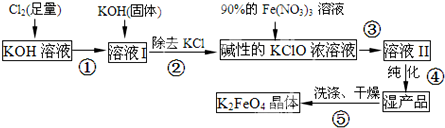
(1)配制KOH溶液时,是在每100mL水中溶解61.6gKOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是___mol/L.
(2)在溶液I中加入KOH固体的目的是___(填编号).
a.与溶液I中过量的Cl2继续反应,生成更多的KClO
b.KOH固体溶解时会放出较多的热量,有利于提高反应速率
c.为下一步反应提供碱性的环境
d.使KClO3转化为 KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式:___.
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式:___.

(1)配制KOH溶液时,是在每100mL水中溶解61.6gKOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是___mol/L.
(2)在溶液I中加入KOH固体的目的是___(填编号).
a.与溶液I中过量的Cl2继续反应,生成更多的KClO
b.KOH固体溶解时会放出较多的热量,有利于提高反应速率
c.为下一步反应提供碱性的环境
d.使KClO3转化为 KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式:___.
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式:___.
▼优质解答
答案和解析
(1)61.6g KOH固体的物质的量为
=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为
=
L,所以氢氧化钾溶液的物质的量浓度为
=10mol/L,
故答案为:10.0;
(2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误;
故选:A、C;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒:Fe(+3→+6),Cl(+1→-1),最小公倍数为6,所以Fe3+、FeO42-前系数都为2,ClO-、Cl-,前系数都为3,结合质量守恒和电荷守恒可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质为氧气,根据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
故答案为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
| 61.6g |
| 56g/mol |
| 161.6g |
| 1.47×10-3g/L |
| 161.6 |
| 1470 |
| 1.1mol | ||
|
故答案为:10.0;
(2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误;
故选:A、C;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒:Fe(+3→+6),Cl(+1→-1),最小公倍数为6,所以Fe3+、FeO42-前系数都为2,ClO-、Cl-,前系数都为3,结合质量守恒和电荷守恒可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质为氧气,根据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
故答案为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
看了 高铁酸钾(K2FeO4)是一...的网友还看了以下:
世界三种流的关系?涌升流(补偿流)的成因与密度流和风海流的成因都有相同点是不是密度流和风海流是从涌 2020-05-16 …
假设有四条流量a.b.c.d分别为50M,端口总带宽为100M,发生了流量拥塞,进行拥塞管理,其中流 2020-05-31 …
流行性感冒(简称流感)是一种由流感病毒引起的、通过空气传播的、具有高度传染性的急性传染病。据此回答下 2020-11-02 …
流行性感冒(简称流感)是一种由流感病毒引起的、通过空气传播的、具有高度传染性的急性传染病.据此回答下 2020-11-02 …
温度高空气被某种气流虚幻?谁能告诉我夏天温度高的时候,为什么时常看到空气被某种气流虚幻扭曲了似的,那 2020-12-04 …
5.关于洋流流向的几种说法,正确的是()A.凡是东西方向流动的洋流,都是风海流B.凡是南北方向流动的 2020-12-15 …
关于洋流问题关于洋流流向的几种说法,正确的是()A.凡是东西方向流动的洋流,都是风海流B.凡是南北方 2020-12-15 …
流行性感冒(简称流感)是一种由流感病毒引起的、通过空气传播的、具有高度传染性的急性传染病。据此回答下 2020-12-19 …
(2012•株洲)流行性感冒(简称流感)是一种由流感病毒引起的、通过空气传播的、具有高度传染性的急性 2020-12-19 …
2013年第一季度我国网络购物总额再创新高。网购的交易方式主要有第三方支付和货到付款两种,在这两种交 2021-01-09 …