早教吧作业答案频道 -->化学-->
钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.(1)基态Fe原子有个未成对电子,Fe3+的电子排布式为,在基态Ti2+中,电子占据的最高能层具有的
题目详情
钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.
(1)基态Fe原子有___个未成对电子,Fe3+的电子排布式为___,在基态Ti2+中,电子占据的最高能层具有的原子轨道数为___.
(2)液氨是富氢物质,是氢能的理想载体.下列说法正确的是___
A.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
B.相同条件下,NH3的沸点比:PH3的沸点高,且NH3的稳定性强
C.已知NH3与NF3都为三角锥型分子,则N原子都为SP3杂化方式且氮元素的化合价都相同
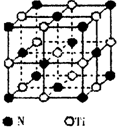
(3)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其细胞结构如图所示:
①设氮化钛晶体中Ti原子与跟它最近邻的N原子之间的距离为r,则与该Ti原子最近邻的Ti的数目为___,Ti原子与跟它次近邻的N原子之间的距离为___,数目为___.
②已知在氮化钛晶体中Ti原子的半径为apm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为___.
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式___.

(1)基态Fe原子有___个未成对电子,Fe3+的电子排布式为___,在基态Ti2+中,电子占据的最高能层具有的原子轨道数为___.
(2)液氨是富氢物质,是氢能的理想载体.下列说法正确的是___
A.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
B.相同条件下,NH3的沸点比:PH3的沸点高,且NH3的稳定性强
C.已知NH3与NF3都为三角锥型分子,则N原子都为SP3杂化方式且氮元素的化合价都相同
(3)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其细胞结构如图所示:
①设氮化钛晶体中Ti原子与跟它最近邻的N原子之间的距离为r,则与该Ti原子最近邻的Ti的数目为___,Ti原子与跟它次近邻的N原子之间的距离为___,数目为___.
②已知在氮化钛晶体中Ti原子的半径为apm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为___.
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式___.
▼优质解答
答案和解析
(1)Fe基态原子电子排布式1s22s22p63s23p63d64s2,在3d轨道有4个未成对电子;Fe原子失去3个电子得电子Fe3+,则Fe3+的电子排布式为1s22s22p63s23p63d5;
基态Ti2+的电子排布式为:1s22s22p63s23p63d2,最高能层为M层,M能层含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;
故答案为:4;1s22s22p63s23p63d5;9;
(2)A.等电子体为原子数相等和价电子数相等的原子团,NH+4与PH+4、CH4、BH-4均含有5个原子团,且价电子均为8,为等电子体,而ClO-4价电子数为32,不属于等电子体,故A错误;
B.分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,元素的非金属性越强,其氢化物越稳定,非金属性N比P强,所以氨气比磷化氢稳定,故B正确;
C.NH3与NF3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,都采用sp3杂化,NH3中N元素为-3价,NF3中N元素为+3价,化合价不同,故C错误;
故答案为:B;
(3)①根据氮化钛晶体可知,在三维坐标中,每一个形成的面上有4个Ti原子,则一个12个Ti原子;Ti原子位于顶点,被8个晶胞共有,即Ti元素与跟它次近邻的N原子个数为8;Ti原子与跟它次近邻的N原子之间的距离为晶胞体对角线的一半,距离为
r,
故答案为:12;8;
r;
②氮化钛晶胞为面心立方密堆积,晶胞中共含有4个Ti和4个N,体积为:
π(a3+b3)×4,晶胞的边长为a+b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为:
=
×
×100%;
故答案为:
×
×100%;
③利用均摊法可知,晶胞中含有碳原子数为8×
=1,含有氮原子数为6×
=3,含有钛原子数为12×
=4,所以碳、氮、钛原子数之比为1:3:4,则化合物的化学式为Ti4CN3,
故答案为:Ti4CN3.
基态Ti2+的电子排布式为:1s22s22p63s23p63d2,最高能层为M层,M能层含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;
故答案为:4;1s22s22p63s23p63d5;9;
(2)A.等电子体为原子数相等和价电子数相等的原子团,NH+4与PH+4、CH4、BH-4均含有5个原子团,且价电子均为8,为等电子体,而ClO-4价电子数为32,不属于等电子体,故A错误;
B.分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,元素的非金属性越强,其氢化物越稳定,非金属性N比P强,所以氨气比磷化氢稳定,故B正确;
C.NH3与NF3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,都采用sp3杂化,NH3中N元素为-3价,NF3中N元素为+3价,化合价不同,故C错误;
故答案为:B;
(3)①根据氮化钛晶体可知,在三维坐标中,每一个形成的面上有4个Ti原子,则一个12个Ti原子;Ti原子位于顶点,被8个晶胞共有,即Ti元素与跟它次近邻的N原子个数为8;Ti原子与跟它次近邻的N原子之间的距离为晶胞体对角线的一半,距离为
| 3 |
故答案为:12;8;
| 3 |
②氮化钛晶胞为面心立方密堆积,晶胞中共含有4个Ti和4个N,体积为:
| 4 |
| 3 |
| ||
| (2a+2b)3 |
| 2π |
| 3 |
| (a3+b3) |
| (a+b)3 |
故答案为:
| 2π |
| 3 |
| (a3+b3) |
| (a+b)3 |
③利用均摊法可知,晶胞中含有碳原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
故答案为:Ti4CN3.
看了 钛铁合金具有吸氢特性,在制造...的网友还看了以下:
完成下列反应化学方程式:(1)金属钠与水反应生成氢气和一种碱;(2)含负一价的氢的化合物(如NaH 2020-04-09 …
化学题、急、在线等高分已知含-1价的化合物[如氢化钠NaH]与水接触生成相应的碱和氢气、则氢化钙与 2020-04-09 …
电极反应中的水和氢氧根和氢离子怎么用 2020-05-16 …
α碳β碳γ碳α氢β氢γ氢分别指得是哪个位置上的碳和氢?请举例说明汗我说的不是同位素。我说的是有机反 2020-05-20 …
已知金属钠投入水中能发生下列反映2Na+2H2O=2NaOH+H2.如将2.3g钠投入水中.充分反 2020-05-21 …
要除去氢气中混有的较多量二氧化碳气体,最好选用前者,为什么?条件是:现有等质量的饱和氢氧化钠溶液和 2020-05-22 …
原油中的碳和氢含量为( )。A.40%~45%B.65%~71%C.84%~87%D.96%~97% 2020-05-31 …
以下有关加热炉炉管破裂后果的描述正确的是( )。A、会导致大量的油和氢气泄漏着火B、会导致压缩 2020-05-31 …
物质的性质决定它的用途,还决定其保存方法.固体KOH具有和氢氧化钠相似的化学性质:实验室中必须将它 2020-06-27 …
己知含负一价的氢的化合物(如NaH)与水接触生成相应的碱和氢气,试写出CaH2与Na2CO3水的溶 2020-07-08 …