早教吧作业答案频道 -->化学-->
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-⇌2Fe2++I2”反应中Fe3+和Fe2+的相互转化.实验如图1所示:(1)待实验Ⅰ溶液颜色不再改变时,再进行
题目详情
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-⇌2Fe2++I2”反应中Fe3+和Fe2+的相互转化.实验如图1所示:
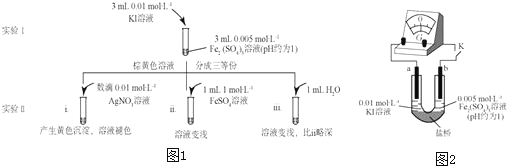
(1)待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ目的是使实验Ⅰ的反应到达___.
(2)ⅲ是ⅱ的对比实验,目的是排除ⅱ中___造成的影响.
(3)ⅰ和ⅱ的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因:___.
(4)根据氧化还原反应的规律,该同学推测I中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+.用图2装置(a、b均为石墨电极)进行实验验证.
①K闭合时,指针向右偏转,b作___极.
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液.产生的现象证实了其推测.该现象是___.
(5)按照(4)的原理,该同学用图2装置进行实验,证实了ⅱ中Fe2+向Fe3+转化的原因.
①转化的原因是___.
②与(4)实验对比,不同的操作是___.
(6)实验Ⅰ中,还原性:I->Fe2;而实验Ⅱ中,还原性Fe2->I-.将(3)和(4)、(5)作对比,得出的结论是___.

(1)待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ目的是使实验Ⅰ的反应到达___.
(2)ⅲ是ⅱ的对比实验,目的是排除ⅱ中___造成的影响.
(3)ⅰ和ⅱ的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因:___.
(4)根据氧化还原反应的规律,该同学推测I中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+.用图2装置(a、b均为石墨电极)进行实验验证.
①K闭合时,指针向右偏转,b作___极.
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液.产生的现象证实了其推测.该现象是___.
(5)按照(4)的原理,该同学用图2装置进行实验,证实了ⅱ中Fe2+向Fe3+转化的原因.
①转化的原因是___.
②与(4)实验对比,不同的操作是___.
(6)实验Ⅰ中,还原性:I->Fe2;而实验Ⅱ中,还原性Fe2->I-.将(3)和(4)、(5)作对比,得出的结论是___.
▼优质解答
答案和解析
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态,否则干扰平衡移动的判断,故答案为:化学平衡状态;
(2)由实验iii和实验ii的对比可知,对比实验的目的是为了排除有ii中水造成溶液中离子浓度改变的影响,故答案为:溶液稀释对颜色的变化;
(3)i.加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-⇌2Fe2++I2平衡逆向移动,可知Fe2+向Fe3+转化,故答案为:Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-⇌2Fe2++I2平衡逆向移动;
ii.加入FeSO4,Fe2+浓度增大,平衡逆移;
①K闭合时,指针向右偏转,右侧为正极,可知b极Fe3+得到电子,则b作正极,故答案为:正;
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黄色沉淀,I-浓度降低,2Fe3++2I-⇌2Fe2++I2平衡逆向移动,指针向左偏转,也可证明推测Fe2+向Fe3+转化,故答案为:左管出现黄色沉淀,指针向左偏转;
(5)①转化的原因为Fe2+浓度增大,还原性增强,使Fe2+还原性强于I-,
故答案为:Fe2+浓度增大,还原性增强,使Fe2+还原性强于I-;
②与(4)实验对比,不同的操作是当指针归零(反应达到平衡)后,向U型管右管中滴加0.01mol/L FeSO4溶液,Fe2+向Fe3+转化,
故答案为:向U型管右管中滴加0.01mol/L FeSO4溶液;
(6)将(3)和(4)、(5)作对比,得出的结论是该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动,
故答案为:该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动.
(2)由实验iii和实验ii的对比可知,对比实验的目的是为了排除有ii中水造成溶液中离子浓度改变的影响,故答案为:溶液稀释对颜色的变化;
(3)i.加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-⇌2Fe2++I2平衡逆向移动,可知Fe2+向Fe3+转化,故答案为:Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-⇌2Fe2++I2平衡逆向移动;
ii.加入FeSO4,Fe2+浓度增大,平衡逆移;
①K闭合时,指针向右偏转,右侧为正极,可知b极Fe3+得到电子,则b作正极,故答案为:正;
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黄色沉淀,I-浓度降低,2Fe3++2I-⇌2Fe2++I2平衡逆向移动,指针向左偏转,也可证明推测Fe2+向Fe3+转化,故答案为:左管出现黄色沉淀,指针向左偏转;
(5)①转化的原因为Fe2+浓度增大,还原性增强,使Fe2+还原性强于I-,
故答案为:Fe2+浓度增大,还原性增强,使Fe2+还原性强于I-;
②与(4)实验对比,不同的操作是当指针归零(反应达到平衡)后,向U型管右管中滴加0.01mol/L FeSO4溶液,Fe2+向Fe3+转化,
故答案为:向U型管右管中滴加0.01mol/L FeSO4溶液;
(6)将(3)和(4)、(5)作对比,得出的结论是该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动,
故答案为:该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动.
看了 为探讨化学平衡移动原理与氧化...的网友还看了以下:
高中化学中有机化合物的那些官能团能与氢氧化钠反应?求与之反应的化学方程式麻烦各位了!第二:哪些官能 2020-04-08 …
A、D、E、F为氧化物,B、C为单质,C不能与稀硫酸反应.F与A的组成元素相同,F的相对分子质量为 2020-05-15 …
求元素化合价与相对原子质量R为核电荷数在1~18间的金属元素,它与足量酸反应生成R(上标n+),已 2020-05-16 …
完全变质或部分变质的氢氧化钠与没变质的氢氧化钠相比,中和反应时消耗强酸的量是()完全变质或部分变质 2020-05-21 …
下列说法正确的是()A.酯化反应的实质是酸与醇反应生成水,与中和反应相似B.醇与所有酸的反应都是酯 2020-07-05 …
竹思高洪波①竹文化是中国特有的文化,假如我们判断不错的话,竹文化应是与儒文化相得益彰的一种文化。在 2020-07-22 …
英语翻译我们的文化应该与其他文化进行更经常的深入交流. 2020-11-04 …
费孝通说:各尽其美,美人之美,美美与共,天下大同。从文化的角度,我们可以这样理解()①不同民族的文化 2020-11-11 …
镁铝性质相似,下表中对两者的对比不正确的是()选项反应铝镁A与非金属能被Cl2、O2氧化能与N2、O 2020-11-11 …
下列说法正确的是()A.酯化反应的实质是酸与醇反应生成水,与中和反应相似B.醇与所有酸的反应都是酯化 2020-12-07 …