早教吧作业答案频道 -->化学-->
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:反应过程化学方程式焓变△H(kJ/mol)活化能Ea(k
题目详情
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=___kJ•mol-1.
(2)在初始阶段,甲烷蒸气重整的反应速率___甲烷氧化的反应速率(填“大于”、“小于”或“等于”).
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的Kp=___; 随着温度的升高,该平衡常数___(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于___.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
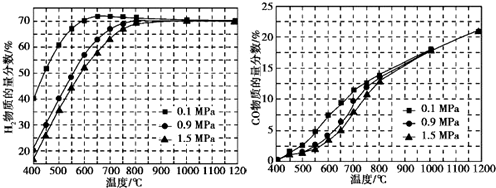
①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是___.
A.600℃,0.9MPa B.700℃,0.9Mpa
C.800℃,1.5MPa D.1 000℃,1.5MPa
②画出600℃,0.1MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是___.
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=___kJ•mol-1.
(2)在初始阶段,甲烷蒸气重整的反应速率___甲烷氧化的反应速率(填“大于”、“小于”或“等于”).
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的Kp=___; 随着温度的升高,该平衡常数___(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于___.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:

①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是___.
A.600℃,0.9MPa B.700℃,0.9Mpa
C.800℃,1.5MPa D.1 000℃,1.5MPa
②画出600℃,0.1MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:

(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是___.
▼优质解答
答案和解析
(1)已知:①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
根据盖斯定律,①-②可得反应:CO(g)+H2O(g)=CO2(g)+H2(g),故△H=165.0kJ/mol-206.2kJ/mol=-41.2kJ/mol,
故答案为:-41.2;
(2)由表中数据可知,甲烷氧化的活化能低于蒸气重整的活化能,活化能越低,反应速率越快,故初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,故答案为:小于;
(3)可知反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的KP=
;
该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大,
故答案为:
;增大;
(4)从能量的角度分析,甲烷自热重整方法的先进之处在于:放热的甲烷氧化反应为吸热的蒸气重整提供能量,提高能源的利用率,
故答案为:放热的甲烷氧化反应为吸热的蒸气重整提供能量;
(5)①由图中数据可知,0.9 MPa时,H2的物质的量分数>65%,CO物质的量分数<10%,则700℃符合,1.5 MPa时,H2的物质的量分数>65%,则温度要高于750℃,CO物质的量分数<10%,低于750℃,矛盾,故B正确,ACD错误,
故选:B;
②起始进料时H2的物质的量分数为0,结合图象可知600℃,0.1 MPa的条件下,平衡时系统中H2的物质的量分数达到70%,H2的物质的量分数随时间变化的示意图为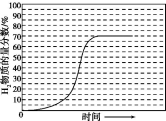 ,故答案为:
,故答案为: ;
;
(6)如果反应过程中进氧气的量过大,会导致生成的氢气和氧气反应,导致质量分数降低,故答案为:导致生成的氢气和氧气反应.
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
根据盖斯定律,①-②可得反应:CO(g)+H2O(g)=CO2(g)+H2(g),故△H=165.0kJ/mol-206.2kJ/mol=-41.2kJ/mol,
故答案为:-41.2;
(2)由表中数据可知,甲烷氧化的活化能低于蒸气重整的活化能,活化能越低,反应速率越快,故初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,故答案为:小于;
(3)可知反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的KP=
| p3(H2)×p(CO) |
| p(CH4)×p(H2O) |
该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大,
故答案为:
| p3(H2)×p(CO) |
| p(CH4)×p(H2O) |
(4)从能量的角度分析,甲烷自热重整方法的先进之处在于:放热的甲烷氧化反应为吸热的蒸气重整提供能量,提高能源的利用率,
故答案为:放热的甲烷氧化反应为吸热的蒸气重整提供能量;
(5)①由图中数据可知,0.9 MPa时,H2的物质的量分数>65%,CO物质的量分数<10%,则700℃符合,1.5 MPa时,H2的物质的量分数>65%,则温度要高于750℃,CO物质的量分数<10%,低于750℃,矛盾,故B正确,ACD错误,
故选:B;
②起始进料时H2的物质的量分数为0,结合图象可知600℃,0.1 MPa的条件下,平衡时系统中H2的物质的量分数达到70%,H2的物质的量分数随时间变化的示意图为
 ,故答案为:
,故答案为: ;
;(6)如果反应过程中进氧气的量过大,会导致生成的氢气和氧气反应,导致质量分数降低,故答案为:导致生成的氢气和氧气反应.
看了 甲烷自热重整是先进的制氢方法...的网友还看了以下:
氢氧化钡与稀硫酸反应热氢氧化钡溶液与稀硫酸反应热与中和热比哪个大?Ba2++SO42-=BaSO4 2020-04-08 …
一道热化学反应题已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,并放出X千焦热量.已知单质碳的燃 2020-05-23 …
高中化学反应热问题反应热=热容*温差,若50ml的氢氧化钠和30ml的硫酸反应,已知溶液比热容和质 2020-06-12 …
在化学反应热的计算中,经常将方程式反写来凑其他的方程式.如果反应不是可逆反应,那反写还有意义吗?比 2020-07-08 …
在化学反应热的计算中,经常将方程式反写来凑其他的方程式.如果反应不是可逆反应,那反写还有意义吗?比 2020-07-14 …
臭氧层中氧分解历程如图所示,下列说法正确的是()A.催化反应①②均为放热反应B.催化剂不能改变该反 2020-07-14 …
800℃时,焦炭与水蒸气反应生成一氧化碳和氢气,反应热△H=+131.3kJ•mol-1,它表示( 2020-07-17 …
800℃时,焦炭与水蒸气反应生成一氧化碳和氢气,反应热△H=+131.3kJ•mol-1,它表示( 2020-07-18 …
已知3.6克的碳在6.4克的氧气中燃烧,至反应物耗完,放出X千焦的热量.已知单质碳的燃烧热为Ykj/ 2020-11-10 …
如果金刚石燃烧生成二氧化碳的反应热大于石墨燃烧生成二氧化炭的反应热,则可断定从石墨变为金刚石的变化要 2020-12-24 …