某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是()A.a、c两点溶液的导电能力相同B.b点溶液中c(H+)+c(NH3•H2O)=c(OH-)C.用等
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )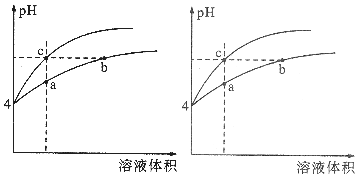
A. a、c两点溶液的导电能力相同
B. b点溶液中c(H+)+c(NH3•H2O)=c(OH-)
C. 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc
D. a、b、c三点溶液中水的电离程度a>b>c
A.溶液的导电能力和溶液中自由移动离子的多少有关,当溶液的体积相等时,a、c两点溶液的离子浓度不一样,所以导电能力不一样,故A错误;
B.b点溶液中,根据质子守恒,得出c(OH-)+c(NH3•H2O)=c(H+),故B错误;
C.用等浓度NaOH溶液和等体积b、c处溶液反应,b点为铵根水解导致溶液呈酸性,b点溶液中铵根和氢离子均消耗NaOH,而c点只有盐酸消耗NaOH(盐酸完全电离),故消耗NaOH溶液体积Vb>Vc,故C正确;
D.盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小,水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH
故选CD.
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是() 2020-05-13 …
Matlab 双纵坐标画图(左坐标中画两条曲线,右坐标画一条曲线)如图中的曲线所示,左坐标中画两条 2020-05-16 …
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是() 2020-07-21 …
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是() 2020-07-30 …
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是()A.XZ线上任意点均呈中性,pH=7 2020-11-01 …
(2014•益阳模拟)如图表示溶液中c(H+)和c(OH-)的关系,下列判断正确的是()A.图中T1 2020-11-12 …
水的电离常数如图两条曲线a与b所示,曲线中的点都符合c(H+)×c(OH-)=常数.下列说法正确的是 2020-12-23 …
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是()A.两条曲线间任意点均有c(H+)× 2020-12-24 …
如图表示水中c(H+)和c(OH-)的关系.下列判断正确的是()A.图中T1>T2B.XZ线上任意点 2020-12-24 …
在物质进出人体细胞的方式中,与下面两图曲线都符合的是()A.红细胞从血浆中吸收K+B.白细胞吞噬病菌 2020-12-24 …