早教吧作业答案频道 -->化学-->
高纯MnCO3是广泛用于电子行业的强磁性材料.MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解.Ⅰ.实验室以MnO2为原料制备MnCO3(1)制备MnSO4溶液:①主要
题目详情
高纯MnCO3是广泛用于电子行业的强磁性材料.MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解.
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图1,缓缓通入经N2稀释的SO2气体,发生反应的化学方程式为___.下列措施中,目的是加快化学反应速率的是___(填标号).
A.MnO2加入前先研磨
B.搅拌
C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)=2NaHSO4+SO2↑+H2O.选择图2所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有___(填标号).
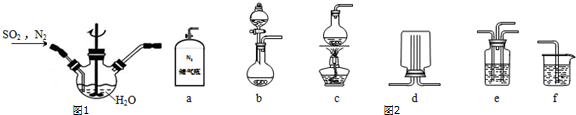
③若用空气代替N2进行实验,缺点是___.(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;②…;③在70-80℃下烘干得到纯净干燥的MnCO3固体.
②需要用到的试剂有___.
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3)___.
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全___.[查阅资料表明K2(H2SO4)=1.1×10-2].
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图1,缓缓通入经N2稀释的SO2气体,发生反应的化学方程式为___.下列措施中,目的是加快化学反应速率的是___(填标号).
A.MnO2加入前先研磨
B.搅拌
C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)=2NaHSO4+SO2↑+H2O.选择图2所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有___(填标号).

③若用空气代替N2进行实验,缺点是___.(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;②…;③在70-80℃下烘干得到纯净干燥的MnCO3固体.
②需要用到的试剂有___.
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3)___.
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全___.[查阅资料表明K2(H2SO4)=1.1×10-2].
▼优质解答
答案和解析
(1)①根据题干,亚硫酸与二氧化锰反应生成硫酸锰和水,方程式为H2SO3+MnO2═MnSO4+H2O;MnO2研磨、反应时搅拌均可以增大接触面积,加快反应速率,提高混合其中N2比例,二氧化硫的浓度减小,反应速率减小,
故答案为:H2SO3+MnO2═MnSO4+H2O;AB;
②反应不需要加热制备二氧化硫,b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止尾气中二氧化硫污染空气,
故选:abef;
③制备原理为:H2SO3+MnO2═MnSO4+H2O,若用空气代替N2进行实验,氧气能与亚硫酸反应生成硫酸,二氧化硫利用率降低,
故答案为:空气中的O2能氧化H2SO3,使SO2利用率下降;
(2)步骤②为洗涤杂质,用盐酸酸化的BaCl2溶液检验硫酸根离子是否洗净;MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,应用酒精洗涤,可以防止被氧化,因溶解导致的损失,
故答案为:盐酸酸化的BaCl2溶液、乙醇;
(3)向MnCO3固体中滴入NiNO3溶液,白色固体转化为浅绿色固体,说明Ksp(MnCO3)sp(NiCO3),
故答案为:向Na2CO3溶液中滴加0.1 mol•L-1的NiSO4溶液直至浅绿色沉淀不再增加,再滴加少量0.1 mol•L-1的MnSO4溶液,沉淀变成白色;
(4)证明H2SO4的第二步电离不完全,用pH计测量Na2SO4溶液的pH大于7,说明H2SO4的第二步电离不完全,
故答案为:用pH计测量Na2SO4溶液的pH大于7.
故答案为:H2SO3+MnO2═MnSO4+H2O;AB;
②反应不需要加热制备二氧化硫,b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止尾气中二氧化硫污染空气,
故选:abef;
③制备原理为:H2SO3+MnO2═MnSO4+H2O,若用空气代替N2进行实验,氧气能与亚硫酸反应生成硫酸,二氧化硫利用率降低,
故答案为:空气中的O2能氧化H2SO3,使SO2利用率下降;
(2)步骤②为洗涤杂质,用盐酸酸化的BaCl2溶液检验硫酸根离子是否洗净;MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,应用酒精洗涤,可以防止被氧化,因溶解导致的损失,
故答案为:盐酸酸化的BaCl2溶液、乙醇;
(3)向MnCO3固体中滴入NiNO3溶液,白色固体转化为浅绿色固体,说明Ksp(MnCO3)
故答案为:向Na2CO3溶液中滴加0.1 mol•L-1的NiSO4溶液直至浅绿色沉淀不再增加,再滴加少量0.1 mol•L-1的MnSO4溶液,沉淀变成白色;
(4)证明H2SO4的第二步电离不完全,用pH计测量Na2SO4溶液的pH大于7,说明H2SO4的第二步电离不完全,
故答案为:用pH计测量Na2SO4溶液的pH大于7.
看了 高纯MnCO3是广泛用于电子...的网友还看了以下:
四、作图题1.把图1中各电路元件接成串联电路.2.把图2中各电路元件接成并联电路(电键接在干路上). 2020-03-30 …
1.电源的电动势是1.5伏,外电路的电阻是3.5欧,连在电源两级上的电压表的示数是1.4伏,求电源 2020-05-21 …
两灯串联,电源电压为6,灯1正常灯2断开,灯1两端电压为0,灯2两端电压为6,为什么一个电路中有灯 2020-06-04 …
有人在调制电路时用一个“100kΩ1/8W”的电阻和一个“300kΩ1/81W”的电阻串联作为40 2020-06-12 …
1.某电子点火器用的是1号干电池,某袖珍收音机用的是7号电池.新的1号干电池和7号干电池的电动势是 2020-06-22 …
一节干电池的电动势为1.5V,其物理意义可以表述为()A.外电路断开时,路端电压是1.5VB.外电 2020-06-22 …
如图所示电路中,电源电动势E=2V,内电阻r=0.1Ω,R=1.9Ω,电流表、电压表对电路的影响不 2020-07-12 …
充电电池充电器的耗电计算假设有4个充电器ABCDA.输出1.2V,100mA,对1个充电电池充电B 2020-07-17 …
电极电势?急问由标准钴电极和标准氯电极组成原电池,测得其电动势1.63V,此时钴电极作负极,现已知氯 2020-11-01 …
对于不同型号的干电池,下列说法正确的是()A.1号干电池的电动势大于5号干电池的电动势B.1号干电池 2020-11-17 …