早教吧作业答案频道 -->化学-->
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应),某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.Ⅰ.
题目详情
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应),某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.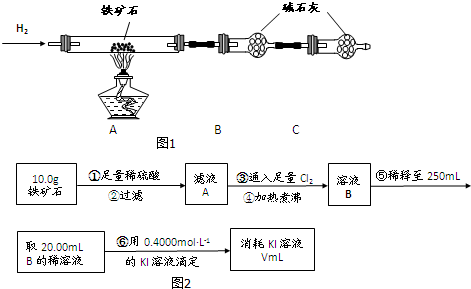
Ⅰ.铁矿石中含氧量的测定;
①按如图1组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为___;
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为___;
(3)若将H2换成CO,则还需补充___装置.
Ⅱ.铁矿石中含铁量的测定如图2所示
(1)步骤④中煮沸的作用是___;
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、___;
(3)下列有关步骤⑥的操作中说法正确的是___
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol•L-1KI溶液20.00ml,则铁矿石中铁的百分含量为___;
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为___.

Ⅰ.铁矿石中含氧量的测定;
①按如图1组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为___;
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为___;
(3)若将H2换成CO,则还需补充___装置.
Ⅱ.铁矿石中含铁量的测定如图2所示
(1)步骤④中煮沸的作用是___;
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、___;
(3)下列有关步骤⑥的操作中说法正确的是___
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol•L-1KI溶液20.00ml,则铁矿石中铁的百分含量为___;
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为___.
▼优质解答
答案和解析
Ⅰ.(1)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,所以C装置要防止防止空气中的水蒸气和CO2进入B中,影响测定结果,
故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;
(2)测的反应后装置B增重1.35g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是:
×100%=24%,
故答案为:24%;
(3)因CO有毒,不能排放到空气中,应加尾气处理装置,
故答案为:尾气处理;
Ⅱ.(1)向铁矿石中加入硫酸,酸化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸的作用是赶走溶液中溶解的过量的Cl2,否则会影响与KI的反应,带来实验误差,
故答案为:赶走溶液中溶解的过量的Cl2;
(2)若稀释到250mL,采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,
故答案为:250mL容量瓶;
(3)a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;
b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,不能确定是否达到滴定终点,故b错误;
c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;
d.锥形瓶不需要用待测液润洗,故d正确;
e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;
f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确.
故答案为:df;
(4)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,反应的方程式为2Fe3++2I-=2Fe2++I2,结合方程式可知,c(Fe3+)=c(KI)=0.5mol•L-1,所以铁元素的百分含量为:
×100%=70%,
故答案为:70%;
Ⅲ.铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:
:
=5:6,铁的氧化物的化学式为:Fe5O6,
故答案为:Fe5O6.
故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;
(2)测的反应后装置B增重1.35g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是:
| ||
| 5.0 |
故答案为:24%;
(3)因CO有毒,不能排放到空气中,应加尾气处理装置,
故答案为:尾气处理;
Ⅱ.(1)向铁矿石中加入硫酸,酸化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸的作用是赶走溶液中溶解的过量的Cl2,否则会影响与KI的反应,带来实验误差,
故答案为:赶走溶液中溶解的过量的Cl2;
(2)若稀释到250mL,采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,
故答案为:250mL容量瓶;
(3)a.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故a错误;
b.滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,不能确定是否达到滴定终点,故b错误;
c.滴定管用蒸馏水洗涤后必须用标准液润洗,故c错误;
d.锥形瓶不需要用待测液润洗,故d正确;
e.滴定过程中,眼睛注视锥形瓶中颜色的变化,故e错误;
f.滴定结束后,30s内溶液不恢复原来的颜色再读数,故f正确.
故答案为:df;
(4)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,反应的方程式为2Fe3++2I-=2Fe2++I2,结合方程式可知,c(Fe3+)=c(KI)=0.5mol•L-1,所以铁元素的百分含量为:
| 0.5mol/L×0.25L×56g/mol |
| 10g |
故答案为:70%;
Ⅲ.铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:
| 70 |
| 56 |
| 24 |
| 16 |
故答案为:Fe5O6.
看了 铁矿石是工业炼铁的主要原料之...的网友还看了以下:
绿色试剂—双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式:KCN 2020-04-05 …
“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为 2020-04-05 …
决定物质性质的重要因素是物质结构.请回答下列问题:(1)铜是过渡元素.化合物中,铜常呈现+1价或+ 2020-05-14 …
多数金属以矿物形式存在于自然界,金属矿物可用来冶炼金属.冶炼方法反应表示式(其他产生略去)代表性金 2020-07-10 …
用氧化物形式表示下列化合物或矿物.用氧化物形式表示下列化合物或矿物.CaSiO3、长石(KALSi3 2020-11-05 …
双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN),化学方程式为:KCN+ 2020-12-16 …
“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式为:KC 2020-12-16 …
“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为: 2020-12-16 …
双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N为-3价),化学方 2020-12-16 …
(1)“绿色氧化剂”双氧水可作为采矿业废液消毒剂,如果要消除采矿业废液中的氰化物(如KCN),化学反 2020-12-16 …