(14分)铁及其化合物在日常生活中有广泛应用。(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式。(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是
(14分)铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式 。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是
设计实验检验绿矾是否完全变质
(3)利用绿矾制备还原铁粉的工业流程如下:
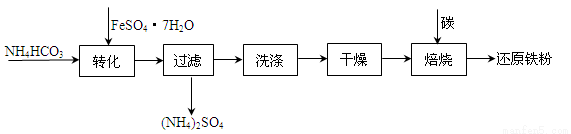
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为
②取干燥后的FeCO3样品12.49g ,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量
(4)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
Fe(s)+5CO(g) 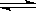 Fe(CO)5(g) ΔH<0
Fe(CO)5(g) ΔH<0
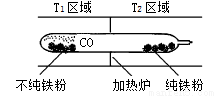
T1 T2(填“>”、“<”或“=”),判断理由是
分 析:
(1)Fe(OH)2转化为Fe(OH)3的化学方程式为4Fe(OH)2+O2 +2H2O4Fe(OH)3。(2)绿矾(FeSO4·7H2O)易变质,Fe2+被氧化为Fe3+,检验绿矾是否变质的试剂是KSCN溶液;检验绿矾是否完全变质即检验样品中是否存在Fe2+,可利用Fe2+的还原性进行检验或用铁氰化钾溶液检验,实验方案为取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质(或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质)。(3)①FeCO3·nH2O在空气中被氧化为FeOOH化学方程式为4FeCO3·nH2O+O24FeOOH+4CO2+(4n-2)H2O;②设样品中FeCO3的物质的量为xmol,FeOOH的物质的量为ymol,则116x+89y=12.49,x+y=6.16/56=0.11,解得y=0.01mol,样品中杂质FeOOH的质量为0.89g;(4)反应Fe(s)+5CO(g) Fe(CO)5(g) ΔH<0,铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到较高温度区域T2时,羰基合铁分解,纯铁粉残留在右端,一氧化碳循环利用,故T1<T2。
考点:
考查铁及其化合物的性质,化学平衡移动原理的应用及化学计算等。 考点
分析:
考点1:物质的制备 考点2:铁及其化合物 考点3:铜及其化合物 试题属性 题型: 难度: 考核: 年级
绿色试剂—双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式:KCN 2020-04-05 …
“绿色试剂”双氧水可作为矿业废液消 毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式 2020-04-05 …
原题是:吡罗红,甲基绿染色剂的成分是什么:1.吡罗红,甲基绿.2.吡罗红,甲基蓝.3.清水.4.蒸 2020-05-14 …
属于浸出药剂的是()A.软膏剂B.汤剂C.乳剂D.溶胶剂E.散剂 2020-05-31 …
下列剂型属于经胃肠道给药剂型的是( )A.喷雾剂B.粉雾剂C.溶液剂D.洗剂E.栓剂 2020-06-07 …
用吡罗红甲基绿染色剂对人口腔上皮细胞进行染色,结果发现细胞核呈绿色,细胞质呈红色.下列解释中正确的 2020-06-17 …
原题是:吡罗红,甲基绿染色剂的成分是什么:1.吡罗红,甲基绿.2.吡罗红,甲基蓝.3.清水.4.蒸 2020-07-14 …
下表中关于生物实验试剂的使用,不正确的()试剂用途加入试剂后是否加热实验结果A双缩脲试剂检测蛋白质 2020-07-14 …
用吡罗红甲基绿染色剂对人口腔上皮细胞进行染色,结果发现细胞核呈绿色,细胞质呈红色.下列解释中正确的 2020-07-14 …
(1)在反应2MnO4-+5H2S+6H+=2Mn2++5S↓+8H2O中,电子转移总数为还原剂为还 2020-12-16 …