早教吧作业答案频道 -->化学-->
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质.Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期.(1
题目详情
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质.Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期.
(1)实验室用H2XO4制取XO2气体的化学反应方程式为___.(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1mol•L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为___.
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式___.
(4)一定条件下,YO与YO2存在下列反应:YO(g)+YO2(g)⇌Y2O3(g),其平衡常数表达式为K=___.
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)═4YO(g)+6H2O(g)△H=-905.8kJ•mol-1;
已知Y2(g)+O2(g)═2YO(g)△H=+180kJ•mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为___.
(6)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).
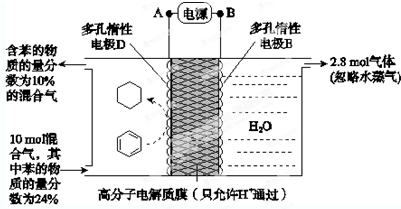
①导线中电子移动方向为___.(用A、D表示)
②生成目标产物的电极反应式为___.
③该储氢装置的电流效率η=___.
(η=
×100%,计算结果保留小数点后1位)
(1)实验室用H2XO4制取XO2气体的化学反应方程式为___.(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1mol•L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为___.
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式___.
(4)一定条件下,YO与YO2存在下列反应:YO(g)+YO2(g)⇌Y2O3(g),其平衡常数表达式为K=___.
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)═4YO(g)+6H2O(g)△H=-905.8kJ•mol-1;
已知Y2(g)+O2(g)═2YO(g)△H=+180kJ•mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为___.
(6)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).

①导线中电子移动方向为___.(用A、D表示)
②生成目标产物的电极反应式为___.
③该储氢装置的电流效率η=___.
(η=
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
▼优质解答
答案和解析
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质,地壳中含量最高的非金属元素为氧元素,与X同主族、与Y同周期,则X为S元素、Y为N元素,Z是地壳中含量最高的金属元素,则Z为Al.
(1)实验室利用亚硫酸钠与硫酸反应或利用Cu与浓硫酸反应等制备二氧化硫,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,或2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O等,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O;
(2)0.1mol•L-1的NaHSO3溶液pH=6,说明HSO3-的电离程度大于其水解程度,故c(Na+)>c(HSO3-),而溶液中水也电离得到H+,故c(H+)>c(SO32-),溶液中氢氧根离子浓度远小于SO32-,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)氧化铝与氢氧化钠反应反应得到偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)反应NO(g)+NO2(g)⇌N2O3(g)的平衡常数k=
,故答案为:
;
(5)已知:①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1;
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,
根据盖斯定律,①-②×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1;
(6)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极,所以电子从A流向D,故答案为:A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C6H6+6H++6e-=C6H12;
③阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气,转移电子的物质的量=2.8mol×4=11.2mol,生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量
×100%=10%,x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则
×100%=64.3%,故答案为:64.3%.
(1)实验室利用亚硫酸钠与硫酸反应或利用Cu与浓硫酸反应等制备二氧化硫,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,或2H2SO4(浓)+Cu
| ||
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或2H2SO4(浓)+Cu
| ||
(2)0.1mol•L-1的NaHSO3溶液pH=6,说明HSO3-的电离程度大于其水解程度,故c(Na+)>c(HSO3-),而溶液中水也电离得到H+,故c(H+)>c(SO32-),溶液中氢氧根离子浓度远小于SO32-,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)氧化铝与氢氧化钠反应反应得到偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)反应NO(g)+NO2(g)⇌N2O3(g)的平衡常数k=
| c(N2O3) |
| c(NO)•c(NO2) |
| c(N2O3) |
| c(NO)•c(NO2) |
(5)已知:①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1;
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,
根据盖斯定律,①-②×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1;
(6)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极,所以电子从A流向D,故答案为:A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C6H6+6H++6e-=C6H12;
③阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气,转移电子的物质的量=2.8mol×4=11.2mol,生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量
| 10mol×24%-x |
| 10mol-3xmol+5.6mol |
| 7.2mol |
| 11.2mol |
看了 X、Y、Z三种短周期元素,其...的网友还看了以下:
1.元素M的氧化物分子式为MxOy,则M的化合价为+1+1-2+62.H,K,O,S四种元素,按给 2020-04-13 …
在古代印度,能够享受到最好教育的是当时的最高种姓。 2020-05-17 …
阅读材料,回答下列问题。(10分)材料一东南亚局部地区示意图材料二印度尼西亚的棕油产量占世界47% 2020-06-17 …
读下图及相关材料,回答下列问题。(20分)材料一西班牙是世界橄榄油第一大生产国。图中阴影部分为安达 2020-07-02 …
(24分)读图及相关材料,回答下列问题。材料一西班牙是世界橄榄油第一大生产国。图中阴影部分为安达卢 2020-07-02 …
被子植物具有()的特点使它们成为陆地上分布最为广泛的植物家族①植株具有根、茎、叶的分化②种子裸露③ 2020-07-06 …
距今7000—6000年前的北方居民种什么,住什么样式的房,用什么陶器?南方居民又种植什么,住什么 2020-07-16 …
我们应该如何对待不同的文化?种族,文化,生活方式等.500多字. 2020-07-22 …
建安风骨,作为中国古典诗学的重要范畴之一,不仅指代汉魏之际雄健深沉、慷慨悲凉的文学风格,也一直是南朝 2020-11-02 …
园林绿化工程造价计算依据?最好详细一点,并举例充分说明:比如苗木的市场价格信息资料啊,完整的绿化种植 2020-11-04 …