早教吧作业答案频道 -->化学-->
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是()A.a点溶液中:水电离出的c(H+)=1×10-12mol/LB.
题目详情
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )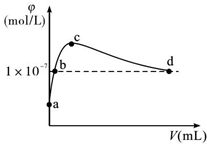
A. a点溶液中:水电离出的c(H+)=1×10-12mol/L
B. b点溶液中:c(H+)=1×10-7mol/L
C. c点溶液中:c(K+)=2[c(CO
)+c(HCO3-)+c(H2CO3)] 2-3
D. d点溶液中:c(K+)=2c(CO
)+c(HCO 2-3
) -3
▼优质解答
答案和解析
a点为氢氧化钾溶液,a到c是生成碳酸钾,b点是碳酸钾和氢氧化钾的混合溶液,c点是单一的碳酸钾溶液,c到d是生成碳酸氢钾,d点是碳酸氢钾和碳酸的混合溶液,d点溶液呈中性,
A.a点溶液中的溶质是KaOH,氢氧化钾抑制了水的电离,溶液中氢离子是水电离的,则水电离出的c(H+)=10-pH=1×10-12mol•L-1,故A正确;
B.b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L,故B错误;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:c(K+)=2[c(CO32-)+c(HCO3)+c(H2CO3)],故C正确;
D.d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,c(H+)=c(OH-),结合电荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),两式相减得:c(K+)=2c(CO32-)+c(HCO3-),故D正确;
故选B.
A.a点溶液中的溶质是KaOH,氢氧化钾抑制了水的电离,溶液中氢离子是水电离的,则水电离出的c(H+)=10-pH=1×10-12mol•L-1,故A正确;
B.b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L,故B错误;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:c(K+)=2[c(CO32-)+c(HCO3)+c(H2CO3)],故C正确;
D.d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,c(H+)=c(OH-),结合电荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),两式相减得:c(K+)=2c(CO32-)+c(HCO3-),故D正确;
故选B.
看了 常温下,将CO2通入2LpH...的网友还看了以下: