早教吧作业答案频道 -->化学-->
矿物燃料在使用的过程中会产生大量污染性物质,如SO2和CO2,而H2和NH3都被认为是理想的清洁能源.(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0(M
题目详情
矿物燃料在使用的过程中会产生大量污染性物质,如SO2和CO2,而H2和NH3都被认为是理想的清洁能源.
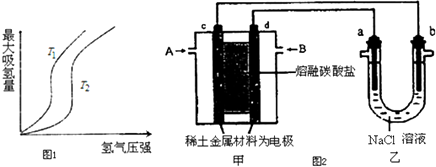
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 (M表示某种合金)如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是___;
a.T1>T2 b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动 d.上述反应可实现多次储存和释放氢气
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL.
①工作过程中,甲装置中d电极上的电极反应式是___;乙装置中电极a为___极(填电极名称).
②若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH=___.(忽略电解前后溶液的体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质.
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1 2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1试写出氨气在氧气中燃烧生成液态水的热化学方程式___;
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:N2(g)+3H2(g)⇌高温高压催化剂2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%.
①该反应的平衡常数表达式为:K=___;
②能判断该反应是否达到化学平衡状态的依据是___
a、容器中压强不变 b、混合气体的密度不变 c、3v正(H2)=2v逆(NH3) d、c(N2):c(H2):c(NH3)=1:3:2
③对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的___
a、选用更高效的催化剂 b、升高温度 c、及时分离出氨气 d、增加H2的浓度 e、充入He,使体系总压强增大.

(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 (M表示某种合金)如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是___;
a.T1>T2 b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动 d.上述反应可实现多次储存和释放氢气
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL.
①工作过程中,甲装置中d电极上的电极反应式是___;乙装置中电极a为___极(填电极名称).
②若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH=___.(忽略电解前后溶液的体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质.
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1 2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1试写出氨气在氧气中燃烧生成液态水的热化学方程式___;
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:N2(g)+3H2(g)⇌高温高压催化剂2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%.
①该反应的平衡常数表达式为:K=___;
②能判断该反应是否达到化学平衡状态的依据是___
a、容器中压强不变 b、混合气体的密度不变 c、3v正(H2)=2v逆(NH3) d、c(N2):c(H2):c(NH3)=1:3:2
③对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的___
a、选用更高效的催化剂 b、升高温度 c、及时分离出氨气 d、增加H2的浓度 e、充入He,使体系总压强增大.
▼优质解答
答案和解析
(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1,
a.T12,故a错误;
b.增大氢气压强,反应速率加快,氢气的吸收速率加快,故b正确;
c.M为固体,增大M的量,浓度不变,上述平衡不移动,故c错误;
d.金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 平衡可以正向或逆向进行,反应可实现多次储存和释放氢气,故d正确;
故答案为:bd;
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体,
图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c电极为负极,与a电极相连的d电极为原电池负极,A端通入氢气,B端通入O2和CO2的混合气体,
①甲装置中d电极为阳极,电极上的电极反应式是氧气得到电子在熔融盐中和二氧化碳反应生成碳酸根离子,电极反应为:O2+4e-+CO2=CO32-,
故答案为:O2+4e-+CO2=CO32-,阳极;
②依据电极反应和电子守恒计算,a极为电解池阳极,产生112mL(标准状况)气体为氢气物质的量=
=0.005mol,电极反应2H++2e-=H2↑,消耗氢离子物质的量为0.01mol,溶液中生成氢氧根离子物质的量为0.01mol,溶液中氢氧根离子浓度c(OH-)=
=0.1mol/L,溶液中c(H+)=
=10-13mol/L,溶液PH=13,
故答案为:13;
(3)①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
②2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1,
阴极盖斯定律计算②×3-①×2写出氨气在氧气中燃烧生成液态水的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol;
(4)①N2(g)+3H2(g)
2NH3(g)△H<0,反应的平衡常数表达式K=
,
故答案为:
;
②a.反应前后气体的化学计量数之和不相等,当达到平衡状态时,压强不变说明反应达到平衡状态,故a正确;
b.反应前后气体的质量不变,容器的体积不变,无论是否达到平衡状态,气体的密度都不变,不能作为判断是否达到平衡状态的依据,故b错误;
c.2v正(H2)=3v逆(NH3),说明正逆反应速率相等,达到平衡状态,但3v正(H2)=2v逆(NH3)不能说明反应达到平衡状态,故c错误;
d.无论是否达到平衡状态,化学反应速率之比都等于化学计量数之比,故d错误;
故答案为:a;
③a、催化剂改变反应速率不改变化学平衡,反应速率增大,平衡不移动,故a错误;
b、反应是放热反应,升高温度反应速率增大,平衡逆向进行,不符合,故b错误;
c、及时分离出氨气,生成物浓度减小反应速率减小,平衡正向进行,不符合,故c错误;
d、增加H2的浓度会增大反应速率,平衡正向进行,故d正确;
e、充入He,使体系总压强增大,气体分压不变,平衡不变,不符合,故e错误;
故选d;
a.T1
b.增大氢气压强,反应速率加快,氢气的吸收速率加快,故b正确;
c.M为固体,增大M的量,浓度不变,上述平衡不移动,故c错误;
d.金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 平衡可以正向或逆向进行,反应可实现多次储存和释放氢气,故d正确;
故答案为:bd;
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体,
图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c电极为负极,与a电极相连的d电极为原电池负极,A端通入氢气,B端通入O2和CO2的混合气体,
①甲装置中d电极为阳极,电极上的电极反应式是氧气得到电子在熔融盐中和二氧化碳反应生成碳酸根离子,电极反应为:O2+4e-+CO2=CO32-,
故答案为:O2+4e-+CO2=CO32-,阳极;
②依据电极反应和电子守恒计算,a极为电解池阳极,产生112mL(标准状况)气体为氢气物质的量=
| 0.112L |
| 22.4L/mol |
| 0.01mol |
| 0.1L |
| 10-14 |
| 0.1 |
故答案为:13;
(3)①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
②2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1,
阴极盖斯定律计算②×3-①×2写出氨气在氧气中燃烧生成液态水的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol;
(4)①N2(g)+3H2(g)
| ||
| 高温高压 |
| c2(NH3) |
| c(N2)c3(H2) |
故答案为:
| c2(NH3) |
| c(N2)c3(H2) |
②a.反应前后气体的化学计量数之和不相等,当达到平衡状态时,压强不变说明反应达到平衡状态,故a正确;
b.反应前后气体的质量不变,容器的体积不变,无论是否达到平衡状态,气体的密度都不变,不能作为判断是否达到平衡状态的依据,故b错误;
c.2v正(H2)=3v逆(NH3),说明正逆反应速率相等,达到平衡状态,但3v正(H2)=2v逆(NH3)不能说明反应达到平衡状态,故c错误;
d.无论是否达到平衡状态,化学反应速率之比都等于化学计量数之比,故d错误;
故答案为:a;
③a、催化剂改变反应速率不改变化学平衡,反应速率增大,平衡不移动,故a错误;
b、反应是放热反应,升高温度反应速率增大,平衡逆向进行,不符合,故b错误;
c、及时分离出氨气,生成物浓度减小反应速率减小,平衡正向进行,不符合,故c错误;
d、增加H2的浓度会增大反应速率,平衡正向进行,故d正确;
e、充入He,使体系总压强增大,气体分压不变,平衡不变,不符合,故e错误;
故选d;
看了 矿物燃料在使用的过程中会产生...的网友还看了以下:
宝宝吃中药期间可以吃益生菌吗 益生菌可以和中药同服吗 2020-03-28 …
你也可以和中国朋友交流来提高中文.是的我经常和朋友一起练习.请翻译英文 2020-04-08 …
2.“和睦”可重叠成“和和睦睦”,“忙碌”可重叠成“忙忙碌碌”这样重叠后2.“和睦”忙碌,可重叠成 2020-04-27 …
1.伦敦是英国最大的城市。isthecityinthe.2.和中国一样,加拿大也是个很大的国家。L 2020-05-14 …
初中数学的提公因式法中的一个疑问?比如(X-2)^2可以和 X^2-4X+4相互转化,那(X-2) 2020-05-17 …
1.为分析某可燃物的成分,将该可燃物2.3g与足量的氧气反应,经测定生成物中只含有4.4g二氧化碳 2020-05-22 …
北宋和辽、西夏政权的并立说明了[]①三个政权势均力敌②中华民族的历史是各族人民共同创造的③汉族、契 2020-07-28 …
北宋和辽、西夏政权的并立说明了①三个政权势均力敌②中华民族的历史是各族人民共同创造的③汉族、契丹族和 2020-11-03 …
口袋里有0-9的数字卡,要求从中任意摸出一张.1.摸出几可以和7组成2和3的倍数.2.摸出几可以和7 2020-11-04 …
(2014•唐山二模)在绕制变压器时,某人误将两个线圈绕在如图所示变压器铁芯的左右两个臂上.当线圈1 2020-11-12 …