早教吧作业答案频道 -->化学-->
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:①从实验装置上看,图中尚缺少的一
题目详情
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是___.
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所测得的中和热的数值会___(填“偏大”“偏小”“无影响”).
(2)某探究实验小组的同学,在进行高锰酸钾酸性溶液与草酸溶液的反应时,发现刚开始的一段时间,反应速率较慢,溶液褪色不明显,但不久后褪色速度明显加快,最后紫红色完全消失.已知草酸与高锰酸钾酸性溶液的反应为:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2+8H2O
该小组探究后一阶段褪色速度明显加快的原因:
①设计对比实验:室温下,在三支试管中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,再对应加入固体粉末,记录褪色时间.实验数据如下:
设计该实验的目的及实验得出的结论分别是:___.
②理论分析:依据该反应的原理,推测反应可能是放热反应,温度影响了反应的速率.请你设计一个简单的实验来验证该推测.你的实验操作是:___.
(3)某研究发现O3氧化海水中的I-是大气中碘的主要来源.通过将O3通入稀硫酸酸化的MaI溶液中进行模拟研究,为测定生成I2的量,用酸式滴定管取20.00mL反应后的溶液与锥形瓶中,用cmol•L-1的Na2S2O3标准液滴定,消耗VmLNa2S2O3溶液.
已知:Ⅰ.H2S2O3是一种弱酸;Ⅱ.2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶、酸式滴定管外,还需要的玻璃仪器是___;
②该滴定实验中可选用___作指示剂(填物质名称);
③实验测得溶液中碘的含量为___g•L-1(用含c和V的关系式表示).
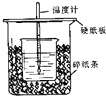
①从实验装置上看,图中尚缺少的一种玻璃用品是___.
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所测得的中和热的数值会___(填“偏大”“偏小”“无影响”).
(2)某探究实验小组的同学,在进行高锰酸钾酸性溶液与草酸溶液的反应时,发现刚开始的一段时间,反应速率较慢,溶液褪色不明显,但不久后褪色速度明显加快,最后紫红色完全消失.已知草酸与高锰酸钾酸性溶液的反应为:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2+8H2O
该小组探究后一阶段褪色速度明显加快的原因:
①设计对比实验:室温下,在三支试管中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,再对应加入固体粉末,记录褪色时间.实验数据如下:
| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
②理论分析:依据该反应的原理,推测反应可能是放热反应,温度影响了反应的速率.请你设计一个简单的实验来验证该推测.你的实验操作是:___.
(3)某研究发现O3氧化海水中的I-是大气中碘的主要来源.通过将O3通入稀硫酸酸化的MaI溶液中进行模拟研究,为测定生成I2的量,用酸式滴定管取20.00mL反应后的溶液与锥形瓶中,用cmol•L-1的Na2S2O3标准液滴定,消耗VmLNa2S2O3溶液.
已知:Ⅰ.H2S2O3是一种弱酸;Ⅱ.2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶、酸式滴定管外,还需要的玻璃仪器是___;
②该滴定实验中可选用___作指示剂(填物质名称);
③实验测得溶液中碘的含量为___g•L-1(用含c和V的关系式表示).

▼优质解答
答案和解析
(1)①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
②一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量小于中和热数值;
故答案为:偏小;
(2)由题意可知探究后一阶段褪色速度明显加快的原因;根据实验 B、C的区别加入的分别是MnSO4和Na2SO4,阳离子不一样,前者速率快,后者基本不变,由此可知Mn2+作催化剂,加快反应速率;
故答案为:探究后一阶段褪色速度明显加快的原因;Mn2+作催化剂,加快反应速率;
②取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察颜色变化时间;
故答案为:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察褪色时间;
(3)①H2S2O3是一种弱酸,则硫代硫酸钠溶液显示碱性,滴定操作中,使用的玻璃仪器有:锥形瓶、烧杯和碱式滴定管,还缺少碱式滴定管,
故答案为:碱式滴定管;
②碘单质遇到淀粉显示蓝色,该滴定中有碘单质的参与,可以使用淀粉作为指示剂,
故答案为:淀粉;
③用c mol•L-1的Na2S2O3标准液滴定,消耗VmLNa2S2O3溶液,消耗硫代硫酸钠的物质的量为:cmol/L×0.001VL=0.001cVmol,
根据反应2Na2S2O3+I2═Na2S4O6+2NaI可知,反应后的溶液中含有碘单质的物质的量为:0.001cVmol×
=0.0005cVmol,碘单质的质量为:254g/mol×0.0005cVmol=0.127cvg,反应后的溶液中的含碘量为:
=6.35cVg/L,
故答案为:6.35cV.
故答案为:环形玻璃搅拌棒;
②一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量小于中和热数值;
故答案为:偏小;
(2)由题意可知探究后一阶段褪色速度明显加快的原因;根据实验 B、C的区别加入的分别是MnSO4和Na2SO4,阳离子不一样,前者速率快,后者基本不变,由此可知Mn2+作催化剂,加快反应速率;
故答案为:探究后一阶段褪色速度明显加快的原因;Mn2+作催化剂,加快反应速率;
②取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察颜色变化时间;
故答案为:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察褪色时间;
(3)①H2S2O3是一种弱酸,则硫代硫酸钠溶液显示碱性,滴定操作中,使用的玻璃仪器有:锥形瓶、烧杯和碱式滴定管,还缺少碱式滴定管,
故答案为:碱式滴定管;
②碘单质遇到淀粉显示蓝色,该滴定中有碘单质的参与,可以使用淀粉作为指示剂,
故答案为:淀粉;
③用c mol•L-1的Na2S2O3标准液滴定,消耗VmLNa2S2O3溶液,消耗硫代硫酸钠的物质的量为:cmol/L×0.001VL=0.001cVmol,
根据反应2Na2S2O3+I2═Na2S4O6+2NaI可知,反应后的溶液中含有碘单质的物质的量为:0.001cVmol×
| 1 |
| 2 |
| 0.127cVg |
| 0.02L |
故答案为:6.35cV.
看了 (1)在如图所示的装置中,5...的网友还看了以下:
1/3H-1/5(H+1)=1/15谁能解这倒方程 2020-04-27 …
已知某商业集团2008-2009年各季度销售资料,如表5-1所示。 则表5-1中,属于时期数列的有( 2020-05-21 …
【问题 1】 (6 分) 请根据图 5-1的项目任务逻辑关系,计算并填写图 5-1 中(1)~(6) 2020-05-25 …
【问题 2】 (3.5 分) 根据图 5-1 中的最早开始时间画出该项目甘特图。 2020-05-26 …
请问错在哪里,应如何改正>>v=0.7:1.2;>>h=0.1:0.5;>>[h,v]=meshg 2020-06-11 …
已知函数h(x)=f(x)+g(x),f(x)是x的正比例函数,g(x)是x的反比例函数,且 h( 2020-06-27 …
11111=100,5个1中间加上一个运算符号,使它等于100.谁会? 2020-07-21 …
想再问一个问题,我这个程序出不来Eelec=50*10^(-9);Tb=1;dtotal=1000 2020-07-23 …
y=x+5/x+1中,自变量x的取值范围 2020-07-25 …
求极限limh→0{[1/(5+h)]-1/5}/h1.limh→0{[1/(5+h)]-1/5}/ 2020-10-31 …