早教吧作业答案频道 -->化学-->
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离
题目详情
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
试回答下列问题:
(1)下列说法正确的是___(选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显___价,根据价层电子对互斥理论可知SO42-的立体构型为___,基态Fe原子有___;个未成对电子,可用硫氰化钾检验Fe3+,形成的配合物的颜色为___.
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是___(选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N3-互为等电子体的分子有:___、___(举二例),写出其中之一的电子式___.
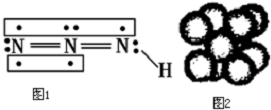
试回答下列问题:
(1)下列说法正确的是___(选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显___价,根据价层电子对互斥理论可知SO42-的立体构型为___,基态Fe原子有___;个未成对电子,可用硫氰化钾检验Fe3+,形成的配合物的颜色为___.
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是___(选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N3-互为等电子体的分子有:___、___(举二例),写出其中之一的电子式___.

▼优质解答
答案和解析
(1)A.HNO2为弱酸,而HNO3是强酸,故A错误;
B.N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B错误;
C.HN3、H2O中都有孤电子对,所以都是极性分子,故C正确;
D.氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键,故D正确.
故答案为:CD;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价为:+3价,SO42-中S原子采用sp3杂化方式,可知SO42-的立体构型为正四面体;26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,硫氰化铁为血红色;.
故答案为:+3;正四面体;4;血红色;
(3)A.NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大,故A错误;
B.钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×
+1=2,故B正确;
C.子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧,故C正确;
D.常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关,故D错误.
故答案为:BC;
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出与N-3互为电子体的分子为CO2、BeCl2等,二氧化碳为共价化合物,其电子式为 ,
,
故答案为:CO2;BeCl2;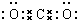 .
.
B.N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B错误;
C.HN3、H2O中都有孤电子对,所以都是极性分子,故C正确;
D.氢键主要存在于N、F、O三种元素的氢化物分子之间,可使物质的熔沸点变大,N2H4沸点高达113.5℃,可以说明肼分子间可形成氢键,故D正确.
故答案为:CD;
(2)在[Co(N3)(NH3)5]SO4中,根据化合价代数和为零,可以算得钴的化合价为:+3价,SO42-中S原子采用sp3杂化方式,可知SO42-的立体构型为正四面体;26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,硫氰化铁为血红色;.
故答案为:+3;正四面体;4;血红色;
(3)A.NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大,故A错误;
B.钠晶胞中,在8个顶点上各有一个原子,体心上还有一个,所以晶胞中钠原子的个数为:8×
| 1 |
| 8 |
C.子的最外层P轨道有3个电子,处于半充满状态,是一种较稳定结构,所以它的第一电离能大于氧,故C正确;
D.常温下很稳定,是因为氮气是双原子分子,两个氮原子之间存在N≡N键,不易断裂,与元素的电负性无关,故D错误.
故答案为:BC;
(4)在N-3中,价电子数为16,根据等电子体原理,可以写出与N-3互为电子体的分子为CO2、BeCl2等,二氧化碳为共价化合物,其电子式为
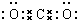 ,
,故答案为:CO2;BeCl2;
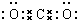 .
.
看了 叠氮化物是一类重要化合物,氢...的网友还看了以下:
图1是桃花的结构模式图,图2是桃的果实示意图,图3是植物细胞示意图请分析回答:(1)从构成生物体的 2020-05-02 …
化学方程式,各写一个1碱性氧化物到碱的化学方程式2非金属氧化物到酸性氧化物的化学方程式3酸性氧化物 2020-05-02 …
图1是甲、乙两种植物单位时间内吸收与释放CO2的量随光照强度变化的曲线.图2是甲植物在不同CO2浓 2020-05-15 …
回答下列以下有关酶的问题:(1)由图1曲线可知:当pH从5上升到7,酶活性的变化过程是;从图示曲线 2020-06-20 …
下列关于Al(OH)3的性质叙述错误的是()A.Al(OH)3是两性氢氧化物B.Al(OH)3是难溶 2020-11-02 …
下列关于Al(OH)3的性质叙述错误的是()A.Al(OH)3是两性氢氧化物B.Al(OH)3是难溶 2020-11-02 …
下列关于氢氧化铝的性质的叙述中错误的是A.Al(OH)3是两性氢氧化物B.Al(OH)3是难溶于水的 2020-11-02 …
氮气是空气的主要成分,氮还是构成蛋白质的重要元素,空气中的氮气只有转变成化合物,才能成为植物生长所需 2020-11-16 …
图1是动物细胞结构模式图,图2是某两栖类蝌蚪尾部退化与某酶(X酶)的关系图,图3是植物细胞质壁分离图 2020-11-20 …
1和3是动物,2和4是近义词的词语比如莺歌燕舞之类的,这个不能写,请各位再写两个, 2020-12-28 …