早教吧作业答案频道 -->化学-->
以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+⇌Cu2++5Fe2++2S.(1)该反应中,Fe3+体现性.(2)上述总反应的原理如
题目详情
以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+⇌Cu2++5Fe2++2S.
(1)该反应中,Fe3+体现___性.
(2)上述总反应的原理如图1所示.负极的电极反应式是___.
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是___.
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol•L-1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中___,证明发生反应 i.
b.取少量Ag2S粉末,加入___溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)用实验 II的浸取液电解提取铜的原理如图2所示:
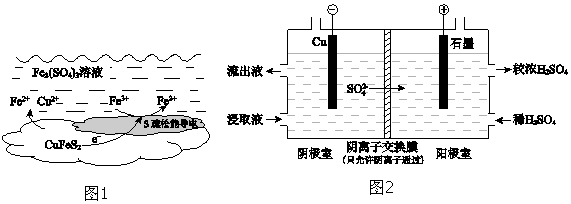
①电解初期,阴极没有铜析出.用电极反应式解释原因是___.
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是___.
(1)该反应中,Fe3+体现___性.
(2)上述总反应的原理如图1所示.负极的电极反应式是___.
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol•L-1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中___,证明发生反应 i.
b.取少量Ag2S粉末,加入___溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)用实验 II的浸取液电解提取铜的原理如图2所示:

①电解初期,阴极没有铜析出.用电极反应式解释原因是___.
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是___.
▼优质解答
答案和解析
(1)CuFeS2+4Fe3+⇌Cu2++5Fe2++2S,反应中铁元素化合价+3价变化为+2价,做氧化剂被还原发生还原反应,
故答案为:氧化;
(2)CuFeS2+4Fe3+⇌Cu2++5Fe2++2S,负极是CuFeS2失电子发生氧化反应,电极反应为:CuFeS2-4e-═Fe2++2S+Cu2+,
故答案为:CuFeS2-4e-═Fe2++2S+Cu2+;
(3)①一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末,加入足量0.10mol•L-1 Fe2(SO4)3溶液,发生反应生成亚铁离子、铜离子和单质硫,其中亚铁离子被氧气氧化为铁离子,通入O2后,发生反应4Fe2++O2+4H+═4Fe3++2H2O,c(Fe2+)降低,c(Fe3+)升高,总反应的平衡正向移动,
故答案为:通入O2后,发生反应4Fe2++O2+4H+═4Fe3++2H2O,c(Fe2+)降低,c(Fe3+)升高,总反应的平衡正向移动;
②a.无明显现象;
b.pH=1的0.10 mol•L-1Fe2(SO4)3溶液;
(4)①电解初期,阴极没有铜析出.浸取液中含过量的铁离子,铁离子氧化性大于铜优先放电,电极反应Fe3++e-═Fe2+,
故答案为:Fe3++e-═Fe2+;
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是Fe2+在阳极失电子生成Fe3+:Fe2+-e-═Fe3+,SO42-通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生,
故答案为:Fe2+在阳极失电子生成Fe3+:Fe2+-e-═Fe3+,SO42-通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生;
故答案为:氧化;
(2)CuFeS2+4Fe3+⇌Cu2++5Fe2++2S,负极是CuFeS2失电子发生氧化反应,电极反应为:CuFeS2-4e-═Fe2++2S+Cu2+,
故答案为:CuFeS2-4e-═Fe2++2S+Cu2+;
(3)①一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末,加入足量0.10mol•L-1 Fe2(SO4)3溶液,发生反应生成亚铁离子、铜离子和单质硫,其中亚铁离子被氧气氧化为铁离子,通入O2后,发生反应4Fe2++O2+4H+═4Fe3++2H2O,c(Fe2+)降低,c(Fe3+)升高,总反应的平衡正向移动,
故答案为:通入O2后,发生反应4Fe2++O2+4H+═4Fe3++2H2O,c(Fe2+)降低,c(Fe3+)升高,总反应的平衡正向移动;
②a.无明显现象;
b.pH=1的0.10 mol•L-1Fe2(SO4)3溶液;
(4)①电解初期,阴极没有铜析出.浸取液中含过量的铁离子,铁离子氧化性大于铜优先放电,电极反应Fe3++e-═Fe2+,
故答案为:Fe3++e-═Fe2+;
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是Fe2+在阳极失电子生成Fe3+:Fe2+-e-═Fe3+,SO42-通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生,
故答案为:Fe2+在阳极失电子生成Fe3+:Fe2+-e-═Fe3+,SO42-通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生;
看了 以黄铜矿(主要成分二硫化亚铁...的网友还看了以下:
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系.在水溶液中橙红色的Cr2O72 2020-04-12 …
关于精馏塔的为什么精馏段回流量和提馏段下降液体流量是相等的?难道回流量最终都成了提馏段的液体了么? 2020-05-16 …
在中性含有Na+的溶液中,还可能存在NH4+,Fe2+,Br-,CO2-3,I-,SO2-3六种离 2020-05-17 …
某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色 2020-07-02 …
某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色 2020-07-02 …
下列关于物质或离子检验的叙述正确的是()A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+ 2020-07-03 …
某中性含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中 2020-10-29 …
黄色溶液中慢慢加入浅绿色的溶液时颜色会变成什么色来源:稀盐酸除铁锈时,先反应生成黄色的铁离子,过度除 2020-11-24 …
对于某些离子的检验及结论一定正确的是()A.通入Cl2后,溶液变为黄色,加淀粉液后溶液变蓝,则原溶液 2020-12-23 …
读“黄河水系图”,回答:(1)写出图中代号表示的地理事物.A(支流)B、(高原)C、(平原)D、(海 2020-12-25 …