氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯1905年发明的,其合成原理为:N2(g)+3H2(g)2NH3(g),△H=-92.4kJ/mol,△S=-1
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术
叫哈伯法,是德国人哈伯1905年发明的,其合成原理为:N 2 (g) + 3H 2 (g)  2NH 3 (g),△H=-92.4 kJ/mol,△ S = -198.3J·mol - 1 ·K - 1 。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH 3 (g),△H=-92.4 kJ/mol,△ S = -198.3J·mol - 1 ·K - 1 。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
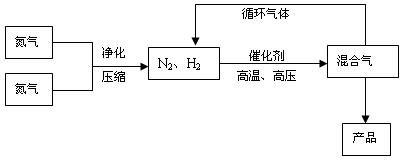
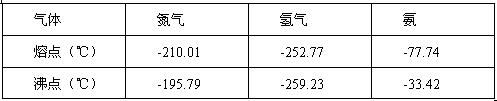
反应体系中各组分的部分性质见下表:
(1)下列说法正确的是
A. 因为△H= -92.4 kJ/mol,所以该反应一定能自发进行
B. 因为△ S = -198.3J·mol - 1 ·K - 1 所以该反应一定不能自发进行
C. 该反应在一定条件下可能自发进行。
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 。
(3)一定温度下,在密闭容器中充入1 mol N 2 和3 mol H 2 并发生反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N 2 的转化率 а 1 = ,此时反应放热 kJ;
②若容器压强恒定,则达到平衡时,容器中N 2 的转化率 а 2 а 1 (填“>、<或=”)。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N 2 (g)+3H 2 (g) 2NH 3 (g) 反应的影响。
2NH 3 (g) 反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)
① 图像中T 2 和T 1 的关系是:T 2 T 1 ,(填“高于”“低于”“等于”“无法确定”)
② 比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是 (填字母)。
③ 在起始体系中加入N 2 的物质的量为n/3mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H 2 的转化率为60%,则此条件下(T 2 ),反应的平衡常数K= 。(不用写单位)
(15分)
(1)C(1分) (2) -33.4℃以下或-195.79℃以上
(2分) N 2 和H 2 (2分)
(3) ① 25% , -1/4△H 或23.1 (各2分) ② > (1分)
(4)① 低于 (1分) ② c (2分) ③ 2.08(2分)
22、牧场之国、带着问题来读书.1“牧场之国”指的是它又被称为之国,之国,之国,之国.2课文按顺序 2020-04-25 …
数列{ an } 中,a1 =1,对于所有的n≥2,n∈ N* 都有 a1 × a2 ×a3×…… 2020-05-16 …
1“牧场之国”指的是它又被称为之国,之国,之国,之国.2课文按 2020-07-04 …
如何从晶体结构的知识来说明氮气的熔沸点比氧气高?我都查过熔沸点的数据,氮气的熔点比氧气的高(N2为 2020-07-06 …
寒带针叶林中两个动物种群(N1、N2)的数量变化如图所示,据图判断这两个种群的关系是()A.捕食关 2020-07-20 …
为什么变压器中U1:U2=n1:n2为什么变压器中U1:U2=n1:n2,我们老师说U1=n1ΔΦ/ 2020-11-03 …
Mid(x,n1,n2)是一个截取字符串的函数.其中x为一个字符串变量,n1为截取的起始位置,n2为 2020-11-07 …
英语翻译这里是东方之珠,世界和平的摇篮.为之人类和平,为之国际众多疑难问题的解决,为之朝鲜半岛目前的 2020-11-23 …
英语翻译我是中国的朝鲜同胞,历经32年的努力,有关人类和平方面中的理论已经全面完成,揭开人类世界和平 2020-12-05 …
lim(1/n2+2/n2+3/n2+……n/n2)为什么不等于lim1/n2+lim2/n2+li 2020-12-15 …