早教吧作业答案频道 -->化学-->
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:(1)氯化亚砜遇水会产生白雾,并产生能使品红溶液褪色的气体.①写出氯化亚砜与
题目详情
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
(1)氯化亚砜遇水会产生白雾,并产生能使品红溶液褪色的气体.①写出氯化亚砜与水反应的化学方程式:___.
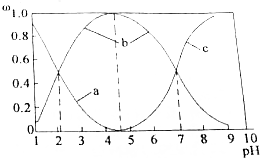
②与SOCl2中硫元素同价态的硫的含氧酸在溶液中存在三种含硫微粒,条件该含氧酸溶液的pH值,三种含硫微粒的物质的量分数(ω)随pH变化曲线如图所示:按顺序写出a、b、c代表的三种微粒的化学式___;该含氧酸二级电离平衡常数Ka2=___.
(2)直接加热AlCl3•6H2O固体过程中会生成中间产物碱式氯化铝[Al2(OH)nCl(6-n)].
①若
×100%=40%,则n=___(结果保留整数)
②将AlCl3•6H2O固体与氯化亚砜混合后加热可得无水AlCl3,试分析氯化亚砜所起的作用:___;
(3)SOCl2不稳定,加热到一定温度可分解生成Cl2、SO2、S2Cl2(常温下呈液态),写出分解的方程式:___,当转移3mol电子时,所得氧化产物的物质的量为___.
(4)一种新型超级可充电电池以金属锂和SOCl2分别作负极、正极的活性物质,电解液为LiAlCl4-SOCl2,放电时生成LiCl、S、SO2,写出充电时阳极电极反应式:___.

(1)氯化亚砜遇水会产生白雾,并产生能使品红溶液褪色的气体.①写出氯化亚砜与水反应的化学方程式:___.
②与SOCl2中硫元素同价态的硫的含氧酸在溶液中存在三种含硫微粒,条件该含氧酸溶液的pH值,三种含硫微粒的物质的量分数(ω)随pH变化曲线如图所示:按顺序写出a、b、c代表的三种微粒的化学式___;该含氧酸二级电离平衡常数Ka2=___.
(2)直接加热AlCl3•6H2O固体过程中会生成中间产物碱式氯化铝[Al2(OH)nCl(6-n)].
①若
| m(碱式氯化铝) |
| m(起始AlCl3•6H2O) |
②将AlCl3•6H2O固体与氯化亚砜混合后加热可得无水AlCl3,试分析氯化亚砜所起的作用:___;
(3)SOCl2不稳定,加热到一定温度可分解生成Cl2、SO2、S2Cl2(常温下呈液态),写出分解的方程式:___,当转移3mol电子时,所得氧化产物的物质的量为___.
(4)一种新型超级可充电电池以金属锂和SOCl2分别作负极、正极的活性物质,电解液为LiAlCl4-SOCl2,放电时生成LiCl、S、SO2,写出充电时阳极电极反应式:___.
▼优质解答
答案和解析
(1)①产生能使品红溶液褪色的气体为SO2,还生成HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
②与SOCl2中硫元素同价态的硫的含氧酸为H2SO3,随碱性增强,H2SO3浓度减小、HSO3-浓度增大,碱性较强时主要以SO32-存在,a为H2SO3,b为HSO3-,c为SO32-,
亚硫酸二级电离为:HSO3-⇌H++SO32-,二级电离常数Ka2=
,由图可知pH=7时,溶液中c(HSO3-)=c(SO32-),则二级电离常数Ka2=
=c(H+)=10-7,
故答案为:H2SO3、HSO3-、SO32-;10-7;
(2)①设AlCl3•6H2O为2mol,由Al元素守恒可知Al2(OH)nCl(6-n)为1mol,则
×100%=40%,解得n=4
②AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解,
故答案为:AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(3)SOCl2加热到一定温度可分解生成Cl2、SO2、S2Cl2,反应方程式为:4SOCl2
3Cl2↑+2SO2↑+S2Cl2,反应中氯气是氧化产物,S2Cl2还原产物,当转移3mol电子时,所得氧化产物的物质的量为
=1.5mol,
故答案为:4SOCl2
3Cl2↑+2SO2↑+S2Cl2;1.5mol;
(4)电池总反应为:4Li+2SOCl2 4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
故答案为:4Cl-+S+SO2-4e-=2SOCl2.
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
②与SOCl2中硫元素同价态的硫的含氧酸为H2SO3,随碱性增强,H2SO3浓度减小、HSO3-浓度增大,碱性较强时主要以SO32-存在,a为H2SO3,b为HSO3-,c为SO32-,
亚硫酸二级电离为:HSO3-⇌H++SO32-,二级电离常数Ka2=
| c(H+)×c(SO32-) |
| c(HSO3-) |
| c(H+)×c(SO32-) |
| c(HSO3-) |
故答案为:H2SO3、HSO3-、SO32-;10-7;
(2)①设AlCl3•6H2O为2mol,由Al元素守恒可知Al2(OH)nCl(6-n)为1mol,则
| 54+17n+35.5(6-n) |
| 2×(27+3×35.5+6×18) |
②AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解,
故答案为:AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(3)SOCl2加热到一定温度可分解生成Cl2、SO2、S2Cl2,反应方程式为:4SOCl2
| ||
| 3mol |
| 2 |
故答案为:4SOCl2
| ||
(4)电池总反应为:4Li+2SOCl2
 4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,故答案为:4Cl-+S+SO2-4e-=2SOCl2.
看了 氯化亚砜(SOCl2)液体是...的网友还看了以下:
下面是学习了化学第二单元课题3后,进行“高锰酸钾制取氧气和氧气性质”的探究,请你回忆并回答下列探究 2020-05-14 …
普通酸性锌锰干电池的结构如图1所示.某校科学社团为回收二氧化锰并探究其性质,对废旧的酸性锌锰干电池 2020-05-14 …
在航天航空工业上银铜合金有许多用途.以废旧航天器为原料回收银并制备含铜化工产品的工艺流程如图所示. 2020-06-15 …
分类处理垃圾并使之资源化,是我国实施可持续发展的重要措施之一。回答下题:(1)以下行为属于对垃圾进 2020-06-22 …
胰蛋白酶常被用于研究酶的活性,并常以酪蛋白为底物检测蛋白酶的活力.请分析并回答下列问题:(1)胰蛋 2020-07-03 …
某学校初三化学兴趣小组为制备氮化钙(化学式为Ca3N2),并对产品纯度进行检测,邀请你参与探究活动 2020-07-05 …
某兴趣小组用图1所示流程制取氧气并回收提纯氯化钾和二氧化锰.回答下列问题:(1)写出该反应的化学方程 2020-11-06 …
元素价态的多样性使得物质世界变得更加丰富多彩,请参照示例,用一个化学方程式表示下列核心元素的价态变化 2020-11-28 …
某兴趣小组用图1所示流程制取氧气,并回收提纯氯化钾和二氧化锰.回答下列问题:(1)根据化学方程式计算 2020-12-05 …
(14分)某兴趣小组用下图所示流程制取氧气(反应原理:2KClO32KCl+3O2↑),并回收提纯氯 2021-01-21 …