早教吧作业答案频道 -->化学-->
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图所示:(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加
题目详情
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图所示:
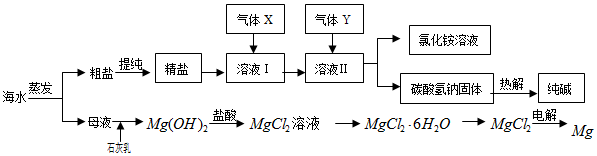
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤___;⑥加适量的盐酸;⑦___.(填操作名称)
(2)流程中通入的气体X为___,理由是___.
(3)溶液Ⅱ中发生反应的化学方程式是:___.
(4)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,试写出该反应的化学方程式___.

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤___;⑥加适量的盐酸;⑦___.(填操作名称)
(2)流程中通入的气体X为___,理由是___.
(3)溶液Ⅱ中发生反应的化学方程式是:___.
(4)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,试写出该反应的化学方程式___.
▼优质解答
答案和解析
(1)将生成的硫酸钡、碳酸钡、碳酸钙、氢氧化镁沉淀从溶液中除去用过滤的方法;氯化钠和盐酸的混合溶液得到氯化钠晶体,可以用蒸发结晶的方法,除去溶液中的氯化氢和水,
故答案为:过滤;蒸发结晶;
(2)相同条件下,氨气的溶解度大于二氧化碳,为了提高二氧化碳的溶解度,先向饱和食盐水中通入氨气,故答案为:NH3;NH3的溶解度大,有利于提高产率;
(3)溶液Ⅱ中为氯化钠和氨水的混合液,为了提高二氧化碳的溶解度,加入二氧化碳后,NaCl、NH3、CO2等发生反应生成NaHCO3和NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(4)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,该反应的化学方程式:MgCl2•6H2O
MgO+2HCl↑+5H2O↑,
故答案为:MgCl2•6H2O
MgO+2HCl↑+5H2O↑.
故答案为:过滤;蒸发结晶;
(2)相同条件下,氨气的溶解度大于二氧化碳,为了提高二氧化碳的溶解度,先向饱和食盐水中通入氨气,故答案为:NH3;NH3的溶解度大,有利于提高产率;
(3)溶液Ⅱ中为氯化钠和氨水的混合液,为了提高二氧化碳的溶解度,加入二氧化碳后,NaCl、NH3、CO2等发生反应生成NaHCO3和NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(4)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,该反应的化学方程式:MgCl2•6H2O
| ||
故答案为:MgCl2•6H2O
| ||
看了 综合利用海水可以制备食盐、纯...的网友还看了以下:
混合物除杂是中学化学实验的基础实验,下列除去杂质的方法不正确的是A除去氨气中的水蒸气:气体通过装有 2020-05-12 …
有一种化学式为FeSO4·m(NH4)2SO4·nH2O的复盐A.将9.6克A与足量浓烧碱溶液共热 2020-05-15 …
0.2mol有机物和0.4molO2在密闭容器中燃烧后的产物是CO2,CO和H2O(g).产物经过 2020-05-16 …
NaOH潮解后极易与空气中的CO2反应生成NaCO3而变质,用同浓度的硫酸,与一瓶未变质部分变质全 2020-05-17 …
有机物A是烃的含氧衍生物,在同温同压下,A蒸气与乙醇蒸气的相对密度是2.1.38gA完全燃烧后,若 2020-07-29 …
现有0.2mol有机物于0.5mol氧气在一密闭容器中燃烧,得产物为CO2、CO、H2O.产物通过浓 2020-10-31 …
1.根据酸碱质子理论,下列叙述中不正确的是1.酸失去质子后就成为碱2.酸越强,其共轭碱也越强3.酸碱 2020-12-23 …
(2011•湖北)欲除去不纯物质中的杂质(括号内为杂质),除去杂质所用方法正确的是()选项待提纯物质 2021-01-05 …
下列除去物质中杂质的方法达不到目的是()物质杂质除杂质的方法A.氯化钠盐酸加热B.铜粉铁粉放到盐酸溶 2021-01-05 …
混合物除杂是中学化学实验的基础实验,下列除去杂质的方法不正确的是()A.除去氨气中的水蒸气:气体通过 2021-01-24 …