早教吧作业答案频道 -->化学-->
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如图:Ca2+Mg2+Fe3+开始沉淀的pH11.99.11.9完全沉淀的pH13.911.13.2已
题目详情
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如图:
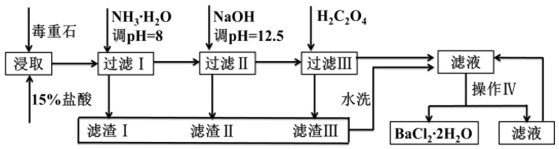
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是___
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有___(至少两条).
(2)加入氨水调节溶液pH=8的目的是___.滤渣Ⅱ中含___(填化学式).加入H2C2O4时应避免过量,原因是___.
(3)操作Ⅳ的步骤是:___、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.通过计算,氯化钡溶液浓度为___ mol•L-1(用含字母的式子表示).

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是___
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有___(至少两条).
(2)加入氨水调节溶液pH=8的目的是___.滤渣Ⅱ中含___(填化学式).加入H2C2O4时应避免过量,原因是___.
(3)操作Ⅳ的步骤是:___、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.通过计算,氯化钡溶液浓度为___ mol•L-1(用含字母的式子表示).
▼优质解答
答案和解析
(1)实验室用37%的盐酸配置15%的盐酸,需量取浓盐酸的体积和水的体积,所以要用量筒,且需使用烧杯作为容器稀释,玻璃棒搅拌,不用的是滴定管,故选d,为了加快毒重石的酸浸速率,可以研磨成粉、加热、搅拌等,增大反应速率,
故答案为:d;研磨成粉、加热、搅拌等;
(2)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,
故答案为:使Fe3+形成Fe(OH)3沉淀而除去;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少;
(3)操作Ⅳ是从氯化钡溶液中获得氯化钡晶体,可以通过蒸发浓缩、冷却结晶、过滤得到,
故答案为:蒸发浓缩、冷却结晶;
(4)步骤Ⅱ:待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42-+2H+═Cr2O72-+H20 的盐酸的物质的量为:V1×10-3×bmol,步骤Ⅰ:用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:V0×10-3×bmol,Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为V0×10-3×bmol-V1×10-3×bmol=(V0-V1)b×10-3mol,步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度为:
mol/L=
mol/L,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大,
故答案为:
.
故答案为:d;研磨成粉、加热、搅拌等;
(2)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,
故答案为:使Fe3+形成Fe(OH)3沉淀而除去;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少;
(3)操作Ⅳ是从氯化钡溶液中获得氯化钡晶体,可以通过蒸发浓缩、冷却结晶、过滤得到,
故答案为:蒸发浓缩、冷却结晶;
(4)步骤Ⅱ:待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42-+2H+═Cr2O72-+H20 的盐酸的物质的量为:V1×10-3×bmol,步骤Ⅰ:用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:V0×10-3×bmol,Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为V0×10-3×bmol-V1×10-3×bmol=(V0-V1)b×10-3mol,步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度为:
| (V 0-V 1)b×10 -3 |
| y×10 -3 |
| (V 0-V1)b |
| y |
故答案为:
| (V 0-V1)b |
| y |
看了 毒重石的主要成分BaCO3(...的网友还看了以下:
某化学兴趣小组的同学利用下图实验装置进行实验室制取气体的探究.请你参与探究,并回答下列问题:(1) 2020-04-08 …
某化学兴趣小组的同学利用如图所示的实验装置进行实验(图中a、b、c表示止水夹).请按要求填空:(1 2020-04-08 …
花卉能否放在卧室里?发现很多回答都是什么花适合放在卧室里,我想问的是,花可不可以放原题是:有人喜欢 2020-05-17 …
坡屋顶内四面空间封闭是否应该计算建筑面积?@1楼不做储藏室,不利用.是说往外承包的时候是否计算面积 2020-05-20 …
学校教室名称翻译成英语,谁来帮我看看对不对!各楼层各室分布一层:消防控制室FireControl, 2020-06-15 …
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为 2020-06-29 …
如图所示,许多空调的室外机都是通过支架悬挂在室外墙壁上的,室外机要经常检查,否则一旦脱落将造成严重 2020-07-05 …
某实验小组探究工业上废渣(主要成分为Cu2S和Fe2O3)的综合利用,过程如下:(1)该小组同学设 2020-07-06 …
在下列各种现象中,分别是怎样利用内能的?(1)利用太阳灶烧水,利用内能;(2)喷气式飞机在飞行,利 2020-07-10 …
实验室常利用以下装置完成气体制备及性质实验.请回答:(1)以上(从A-E中选择)装置有一处明显的错 2020-07-23 …