早教吧作业答案频道 -->化学-->
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.(1)二氧化碳合成甲醇是碳减排的新方向,已知:①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g
题目详情
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
(1)二氧化碳合成甲醇是碳减排的新方向,已知:
①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-677kJ•mol-1
以CO2和H2为原料合成甲醇的热化学方程式为___,
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)___K(B)(填“>”、“<”或“=”).
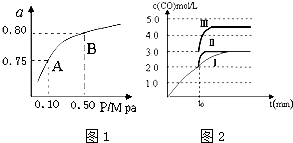
(3)判断反应③△H___0;△S___0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)___v(逆) (填“>”“=”或“<”)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)⇌H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___当曲线Ⅰ变为曲线Ⅲ时,改变的条件是___.利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式___.
(4)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液.
常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
以下离子浓度关系的判断正确的是___
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-).
(1)二氧化碳合成甲醇是碳减排的新方向,已知:
①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-677kJ•mol-1
以CO2和H2为原料合成甲醇的热化学方程式为___,
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)⇌CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)⇌H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)⇌CH3OH(g)+H2O (g) | K3 | ||

(3)判断反应③△H___0;△S___0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)___v(逆) (填“>”“=”或“<”)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)⇌H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___当曲线Ⅰ变为曲线Ⅲ时,改变的条件是___.利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式___.
(4)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液.
常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-).
▼优质解答
答案和解析
(1)①2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H=-677kJ•mol-1;依据盖斯定律①×
-②得到CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1;
故答案为:CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1;
(2)依据平衡常数随温度变化,不随压强变化分析,图象中平衡状态由A变到B时,压强改变,温度不变,所以平衡常数不变,故答案为:=;
(3)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.5×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,Q=
=0.93<K=2.5,反应正向进行,V正>V逆;
故答案为:<;<;>;
图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L;
该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(4)A.NaHSO3溶液呈酸性,则c(H+)>c(OH-),故A错误;
B.Na2SO3溶液因为亚硫酸根水解生成亚硫酸氢根和氢氧根而呈碱性,亚硫酸氢根还水解生成亚硫酸和氢氧根,所以c(OH-)>c(HSO3-),故B错误;
C.溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故C正确;
D.当n(SO32-):n(HSO3-)=1:1时,溶液不成中性,所以c(Na+)不等于c(HSO3-)+2c(SO32-),故D错误;
故选:C.
②CH3OH(g)+
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1;
(2)依据平衡常数随温度变化,不随压强变化分析,图象中平衡状态由A变到B时,压强改变,温度不变,所以平衡常数不变,故答案为:=;
(3)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.5×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,Q=
| 5×5 |
| 3 3×1 |
故答案为:<;<;>;
图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L;
该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(4)A.NaHSO3溶液呈酸性,则c(H+)>c(OH-),故A错误;
B.Na2SO3溶液因为亚硫酸根水解生成亚硫酸氢根和氢氧根而呈碱性,亚硫酸氢根还水解生成亚硫酸和氢氧根,所以c(OH-)>c(HSO3-),故B错误;
C.溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故C正确;
D.当n(SO32-):n(HSO3-)=1:1时,溶液不成中性,所以c(Na+)不等于c(HSO3-)+2c(SO32-),故D错误;
故选:C.
看了 研究碳氧化物的利用对促进低碳...的网友还看了以下:
关于高中光合作用的小问题碳3化合物变成有机物需要还原氢和ATP;碳3化合物变成碳5化合物时,需要这 2020-04-27 …
碳燃烧时,由于条件不同,可能生成一氧化碳,也可能生成二氧化碳.下列对一氧化碳和二氧化碳比较合理的说 2020-05-13 …
木炭在氧气中燃烧生成二氧化碳,当碳“燃烧不充分”的时候,生成一氧化碳,同时放出热——燃烧不充分?( 2020-05-16 …
请问化学中怎样除去杂质 比如说氧化钙中含有碳酸钙 等等,除杂对生成物有设么要求呀一氧化碳中有二氧化 2020-05-17 …
碳酸氢钾和碳酸钾同时加热,碳酸氢钾生成碳酸钾,二氧化碳和水,碳酸钾则全部转化为氧化钾和二氧化碳(对 2020-07-03 …
是组成碳水化合物的基本元素,在光合作用中C元素从CO2经C3→C5形成(CH2O)A.N是叶绿素的 2020-07-09 …
某课外小组在实验室制备氨气,并进行有关氨气的用途及性质的探究。(1)写出实验室制取氨气的化学方程式 2020-07-22 …
人体是怎样完成碳水化合物的消化吸收的 2020-11-04 …
向氯化钙溶液中通入二氧化碳,出现大量白色沉淀,这难道不对吗?二氧化碳溶进水里生成碳酸,碳酸和氯化钙反 2020-12-24 …
据报导用激光将置于铁室中的石墨靶上的碳原子“炸松”,与此同时再用一个射频电火花喷射出氮气,此时碳、氮 2021-01-13 …