早教吧作业答案频道 -->化学-->
纯碱是重要的化工原料(一)制备探究:如图是工业生产纯碱的主要流程示意图.查阅资料①粗盐水中含有杂质MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,
题目详情
纯碱是重要的化工原料
(一)制备探究:如图是工业生产纯碱的主要流程示意图.
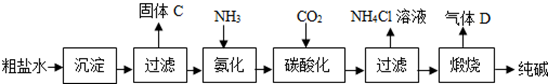
【查阅资料】①粗盐水中含有杂质MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2、CaCl2的化学方程式:___,___.
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是___,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式___.
(3)“碳酸化”后过滤获得的NH4Cl可用作___肥,也可先___(填“加热”或“冷却”)NH4Cl溶液,再加入熟石灰获得循环使用的物质是___;
(4)煅烧制得纯碱的化学方程式是___.
(二)成分探究
【提出问题】纯碱样品中含有哪些杂质?
【猜想】猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;猜想三:___.
【实验探究】确定纯碱中是否含NaHCO3.实验装置和主要实验步骤如下:
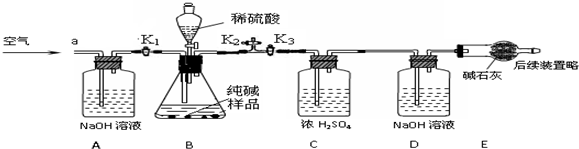
①称量D、E装置总质量为200.0g,将10.6 0g纯碱试样放入锥形瓶中,按上图组装后打开活塞K1和K2,关闭K3,缓缓鼓入一段时间空气;
②关闭活塞K1和K2,打开K3,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
【实验讨论】
(5)加入样品前还应___;
(6)装置A的作用是___,装置C的作用是___;装置E的作用是___;
(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是___,装置B中一定发生的化学反应方程式为___装置D中的化学反应方程式为___.
(8)装置B中生成CO2的质量为___ g.通过计算说明纯碱中___含NaHCO3(填字母).
A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知Na2CO3相对分子质量为106、NaHCO3相对分子质量为84):
(9)另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足___条件时,样品中含有NaCl.
(一)制备探究:如图是工业生产纯碱的主要流程示意图.

【查阅资料】①粗盐水中含有杂质MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2、CaCl2的化学方程式:___,___.
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是___,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式___.
(3)“碳酸化”后过滤获得的NH4Cl可用作___肥,也可先___(填“加热”或“冷却”)NH4Cl溶液,再加入熟石灰获得循环使用的物质是___;
(4)煅烧制得纯碱的化学方程式是___.
(二)成分探究
【提出问题】纯碱样品中含有哪些杂质?
【猜想】猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;猜想三:___.
【实验探究】确定纯碱中是否含NaHCO3.实验装置和主要实验步骤如下:

①称量D、E装置总质量为200.0g,将10.6 0g纯碱试样放入锥形瓶中,按上图组装后打开活塞K1和K2,关闭K3,缓缓鼓入一段时间空气;
②关闭活塞K1和K2,打开K3,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
【实验讨论】
(5)加入样品前还应___;
(6)装置A的作用是___,装置C的作用是___;装置E的作用是___;
(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是___,装置B中一定发生的化学反应方程式为___装置D中的化学反应方程式为___.
(8)装置B中生成CO2的质量为___ g.通过计算说明纯碱中___含NaHCO3(填字母).
A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知Na2CO3相对分子质量为106、NaHCO3相对分子质量为84):
(9)另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足___条件时,样品中含有NaCl.
▼优质解答
答案和解析
(1)除去粗盐水中MgCl2、CaCl2用的试剂是氢氧化钠溶液和碳酸钠溶液,反应的化学方程式分别为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2Na Cl;
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是有利于溶液吸收CO2气体;氯化钠、氨气、二氧化碳和水反应生成碳酸氢钠和氯化铵,反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)“碳酸化”后过滤获得的NH4Cl含有氮元素,所以可用作氮肥;氯化铵不稳定受热易分解或遇到碱放出氨气,也可先加热NH4Cl溶液,再加入熟石灰获得循环使用的物质是NH3(或氨气);
(4)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应的化学方程式为:2NaHCO3
Na2CO3+H2O+CO2↑;
【猜想三】纯碱样品中还可能含有NaHCO3和 NaCl的混合物;
(5)加入样品前还应检查装置气密性;
(6)空气中含有二氧化碳,装置A的作用是除去空气中的二氧化碳;浓硫酸和碱石灰具有吸水性,装置C的作用是除去二氧化碳中的水;装置E的作用是吸收从D中带出的水;
(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是将生成的二氧化碳全部送到D中;碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O;
(8)根据D、E增加的质量为二氧化碳的质量,装置B中生成CO2的质量=204.84g-200.0g=4.84g;
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
=
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠;
(9)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,假设全部是碳酸钠求出增加的质量.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 117
ag×14.6% W
=
W=0.234ag
所以当W的值满足条件W>0.234ag时,样品中含有NaCl;
故答案为:(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2Na Cl;
(2)有利于溶液吸收CO2气体;NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)氮;加热;NH3(或氨气);
(4)2NaHCO3
Na2CO3+H2O+CO2↑;
【猜想三】NaHCO3和 NaCl;
(5)检查装置气密性;
(6)除去空气中的二氧化碳; 除去二氧化碳中的水;吸收从D中带出的水;
(7)将生成的二氧化碳全部送到D中;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;CO2+2NaOH=Na2CO3+H2O;
(8)4.84; A;
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
=
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠;
(9)W>0.234a
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是有利于溶液吸收CO2气体;氯化钠、氨气、二氧化碳和水反应生成碳酸氢钠和氯化铵,反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)“碳酸化”后过滤获得的NH4Cl含有氮元素,所以可用作氮肥;氯化铵不稳定受热易分解或遇到碱放出氨气,也可先加热NH4Cl溶液,再加入熟石灰获得循环使用的物质是NH3(或氨气);
(4)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应的化学方程式为:2NaHCO3
| ||
【猜想三】纯碱样品中还可能含有NaHCO3和 NaCl的混合物;
(5)加入样品前还应检查装置气密性;
(6)空气中含有二氧化碳,装置A的作用是除去空气中的二氧化碳;浓硫酸和碱石灰具有吸水性,装置C的作用是除去二氧化碳中的水;装置E的作用是吸收从D中带出的水;
(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是将生成的二氧化碳全部送到D中;碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O;
(8)根据D、E增加的质量为二氧化碳的质量,装置B中生成CO2的质量=204.84g-200.0g=4.84g;
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
| 106 |
| 10.6g |
| 44 |
| x |
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠;
(9)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,假设全部是碳酸钠求出增加的质量.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 117
ag×14.6% W
| 73 |
| ag×14.6% |
| 117 |
| W |
W=0.234ag
所以当W的值满足条件W>0.234ag时,样品中含有NaCl;
故答案为:(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2Na Cl;
(2)有利于溶液吸收CO2气体;NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)氮;加热;NH3(或氨气);
(4)2NaHCO3
| ||
【猜想三】NaHCO3和 NaCl;
(5)检查装置气密性;
(6)除去空气中的二氧化碳; 除去二氧化碳中的水;吸收从D中带出的水;
(7)将生成的二氧化碳全部送到D中;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;CO2+2NaOH=Na2CO3+H2O;
(8)4.84; A;
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
| 106 |
| 10.6g |
| 44 |
| x |
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠;
(9)W>0.234a
看了 纯碱是重要的化工原料(一)制...的网友还看了以下:
为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究: 2020-06-10 …
某研究小组为探究影响过氧化氢分解的因素,做了三个实验.相应的实验结果如图所示,请分析回答下列问题: 2020-06-18 …
(2014•长沙模拟)某校化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质, 2020-06-21 …
实验探究一:课本第二单元课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探 2020-07-07 …
一个数的非整数次幂怎么求法?要详解如2的根号2次方 2020-07-29 …
一个只有实数根的一元三次方程知一解后如何因式分解?如2(X三次方)+3(X平方)—11X—6=0,知 2020-10-31 …
1.列方程并解答.2又1/2的2/3比一个数的25%少0.1,求这个数.2.探索发现.如果规定x△y 2020-11-01 …
为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:( 2020-11-02 …
初二物理1.冬天,寒风吹到野外的电线上,发出呼呼的哨声,而在夏天却很难听到,这是为什么?请根据声学知 2020-11-14 …
1.方程2*x^3-6*x^2+3=0有几个解?如果有解,全部解的和为多少?2.探究方程2*x^3- 2020-12-23 …