早教吧作业答案频道 -->化学-->
含硫化合物在自然界中广泛存在,部分循环关系如下:(1)已知:2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1写出H2S(g)与O2(g)反应产
题目详情
含硫化合物在自然界中广泛存在,部分循环关系如下:
(1)已知:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1
写出H2S(g)与O2(g)反应产生S(s)和H2O(g)的热化学方程式___.
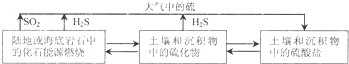
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用离子方程式,从沉淀溶解平衡的角度表示由ZnS转变为CuS的过程___.
(3)某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至Ph=2,过滤后,将所得滤液蒸发浓缩,冷却结晶,过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
①通入H2S气体至饱和的目的是___;用硫酸酸化至pH=2的目的是___.
②在SnS、FeS共存的溶液中,若c(Sn2+)=1.0×10-9mol•L-1,则c(Fe2+)=___.
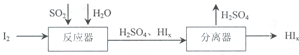
(4)SO2是大气污染物,若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式是___.SO2还可以按下列流程制备化工原料硫酸,反应器中发生反应的化学方程式是___.

(1)已知:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1
写出H2S(g)与O2(g)反应产生S(s)和H2O(g)的热化学方程式___.
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用离子方程式,从沉淀溶解平衡的角度表示由ZnS转变为CuS的过程___.
(3)某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至Ph=2,过滤后,将所得滤液蒸发浓缩,冷却结晶,过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
②在SnS、FeS共存的溶液中,若c(Sn2+)=1.0×10-9mol•L-1,则c(Fe2+)=___.
(4)SO2是大气污染物,若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式是___.SO2还可以按下列流程制备化工原料硫酸,反应器中发生反应的化学方程式是___.

▼优质解答
答案和解析
(1)①2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
②S(s)+O2(g)═SO2(g)△H=-297.04kJ/mol,
由盖地定律可知,①-②×2可得:2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.38kJ/mol,
故答案为:2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1 ;
(2)ZnS的溶解度小于铜蓝(CuS),CuSO4转变为铜蓝的离子方程式:ZnS(S)+Cu2+(aq)⇌Zn2+(aq)+CuS(S);
故答案为:ZnS(S)+Cu2+(aq)⇌Zn2+(aq)+CuS(S);
(3)①通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,除去溶液中的Sn2+离子,并防止Fe2+被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,防止Fe2+离子生成沉淀;
故答案为:将溶液中的Sn2+转变为SnS而除去,防止Fe2+转化为FeS沉淀;
②在SnS、FeS共存的溶液中,FeS+Sn2+=SnS+Fe2+,若c(Sn2+)=1.0×10-9mol•L-1,则K=
=
=
,
c(Fe2+)=
×1.0×10-9mol•L-1=6.3×10-2mol•L-1,
故答案为:6.3×10-2mol•L-1;
(4)若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,流程分析可知二氧化硫和碘单质在水溶液中发生反应生成硫酸和碘化氢,然后在分离器中分离得到硫酸和碘化氢,反应的化学方程式为:SO2+xI2+2H2O=H2SO4+2HIx,
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,SO2+xI2+2H2O=H2SO4+2HIx.
②S(s)+O2(g)═SO2(g)△H=-297.04kJ/mol,
由盖地定律可知,①-②×2可得:2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=-442.38kJ/mol,
故答案为:2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1 ;
(2)ZnS的溶解度小于铜蓝(CuS),CuSO4转变为铜蓝的离子方程式:ZnS(S)+Cu2+(aq)⇌Zn2+(aq)+CuS(S);
故答案为:ZnS(S)+Cu2+(aq)⇌Zn2+(aq)+CuS(S);
(3)①通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,除去溶液中的Sn2+离子,并防止Fe2+被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,防止Fe2+离子生成沉淀;
故答案为:将溶液中的Sn2+转变为SnS而除去,防止Fe2+转化为FeS沉淀;
②在SnS、FeS共存的溶液中,FeS+Sn2+=SnS+Fe2+,若c(Sn2+)=1.0×10-9mol•L-1,则K=
| c(Fe2+) |
| c(Sn2+) |
| Ksp(FeS) |
| Ksp(SnS) |
| 6.3×10-18 |
| 1.0×10-25 |
c(Fe2+)=
| 6.3×10-18 |
| 1.0×10-25 |
故答案为:6.3×10-2mol•L-1;
(4)若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,流程分析可知二氧化硫和碘单质在水溶液中发生反应生成硫酸和碘化氢,然后在分离器中分离得到硫酸和碘化氢,反应的化学方程式为:SO2+xI2+2H2O=H2SO4+2HIx,
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,SO2+xI2+2H2O=H2SO4+2HIx.
看了 含硫化合物在自然界中广泛存在...的网友还看了以下:
已知:2Zn(s)+O2(g)===2ZnO(s)ΔH1=-701.0kJ·mol-12Hg(l) 2020-04-07 …
在摆角很小(小于5°)的情况下,蛋白的周期跟摆长的平方根成正比,跟重力加速度的平方根成反比,用公式 2020-06-13 …
把下面的式子的两边弄成相等的1.FeCl3(aq)+KOH(aq)-->Fe(OH)3(s)+KC 2020-07-09 …
已知热化学反应方程式:Zn(s)+1/2O2(g)=ZnO(s)△H=-351.5kJ/mol;H 2020-07-09 …
用键能可以估算反应热,当以键能来估算反应热时,下列方程式符合要求的是A.CH3COOH(L)+C2H 2020-11-03 …
(2011·潮州高二检测)水的三态的熵值的大小关系正确的是(Sm表示1mol物质的熵值)()A.Sm 2020-11-12 …
编译原理文法设文法G(S):S→(L)|a+S|aL→L,S|S求(1)给出G[S]等价的文法G‘[ 2020-11-23 …
化学方程式里,元素符号后括号里的字母例如:1.2C(s)+O2=2CO(g)2.2CH3OH(l)+ 2020-11-28 …
下列各组热化学方程式中,化学反应的△H前者大于后者的是①C(s)+O2(g)====CO2(g);△ 2020-12-14 …
英文单词分类填空动物类1.O()t()p()s2.k()t()e()3.l()b()t()r4.a( 2021-02-05 …