早教吧作业答案频道 -->化学-->
化学平衡原理是中学化学学习的重要内容.请回答下列问题:(1)①己知:CH4、H2的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和液态H2O的热化学方程式是.②图1是用
题目详情
化学平衡原理是中学化学学习的重要内容.请回答下列问题:
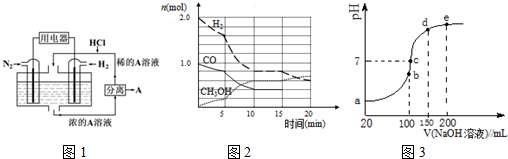
(1)①己知:CH4、H2的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和液态H2O的热化学方程式是___.
②图1是用Pt作电极,N2和H2的原电池.请写出正极的电极反应式___,电解质A是___.
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇.反应为
CO(g)+2H2(g)⇌CH3OH(g).某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图2:
①从反应开始至平衡时,用CO表示化学反应速率为___,该温度下的平衡常数为___.
②5min至10min时速率变化的原因可能是___;
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化).如果溶液pH=7,此时V的取值___20.00(填“>”、“=”或“<”).
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为___(用含有a、b字母的代数式表示).
(4)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2示,分析图中3a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是___;
②在c点,溶液中各离子浓度由大到小的排列顺序是___.

(1)①己知:CH4、H2的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和液态H2O的热化学方程式是___.
②图1是用Pt作电极,N2和H2的原电池.请写出正极的电极反应式___,电解质A是___.
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇.反应为
CO(g)+2H2(g)⇌CH3OH(g).某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图2:
①从反应开始至平衡时,用CO表示化学反应速率为___,该温度下的平衡常数为___.
②5min至10min时速率变化的原因可能是___;
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化).如果溶液pH=7,此时V的取值___20.00(填“>”、“=”或“<”).
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为___(用含有a、b字母的代数式表示).
(4)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2示,分析图中3a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是___;
②在c点,溶液中各离子浓度由大到小的排列顺序是___.
▼优质解答
答案和解析
(1)①已知CH4、H2的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1,可得热化学方程式为:
I.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
Ⅱ.H2(g)+
O2(g)=H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅱ×4-I可得:CO2 (g)+4H2(g)=CH4(g)+2H2O(l)△H=-285.8kJ•mol-1×4+890.3KJ/mol=-252.9 kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9 kJ/mol;
②电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①由图可知10min到达平衡,平衡时甲醇为0.6mol,则:
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol):1 2 0
变化量(mol):0.6 1.2 0.6
平衡量(mol):0.4 0.8 0.6
则v(CO)=
=0.03mol/(L.min),
平衡常数K=
=
=
,
故答案为:0.03mol/(L.min);
;
②5min时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂,
故答案为:反应受热或使用了催化剂;
(3)①若二者恰好反应得到CH3COONa溶液,溶液中CH3COO-水解呈碱性,反应后溶液pH=7,溶液就呈中性,故反应时醋酸应过量,则VmL×0.1000mol•L-1<20.00mL×0.1000mol•L-1,故V<20,
故答案为:<;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,由物料守恒可知c(CH3COOH)=0.5(a-b)mol/L,则CH3COOH的电离常数Ka=
=
=
,
故答案为:
;
(4)①a、b、c、d、e五个点,a点是100mL0.1mol•L-1NH4HSO4溶液的PH,铵根离子水解显酸性,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,溶液中发生水解反应的离子是NH4+,NH4++H2O⇌NH3•H2O+H+,铵根离子水解溶液显酸性,
故答案为:NH4+;
②c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),则c点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
I.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
Ⅱ.H2(g)+
| 1 |
| 2 |
根据盖斯定律,Ⅱ×4-I可得:CO2 (g)+4H2(g)=CH4(g)+2H2O(l)△H=-285.8kJ•mol-1×4+890.3KJ/mol=-252.9 kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9 kJ/mol;
②电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①由图可知10min到达平衡,平衡时甲醇为0.6mol,则:
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol):1 2 0
变化量(mol):0.6 1.2 0.6
平衡量(mol):0.4 0.8 0.6
则v(CO)=
| ||
| 10min |
平衡常数K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| ||||
|
| 75 |
| 8 |
故答案为:0.03mol/(L.min);
| 75 |
| 8 |
②5min时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂,
故答案为:反应受热或使用了催化剂;
(3)①若二者恰好反应得到CH3COONa溶液,溶液中CH3COO-水解呈碱性,反应后溶液pH=7,溶液就呈中性,故反应时醋酸应过量,则VmL×0.1000mol•L-1<20.00mL×0.1000mol•L-1,故V<20,
故答案为:<;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,由物料守恒可知c(CH3COOH)=0.5(a-b)mol/L,则CH3COOH的电离常数Ka=
| c(H+)×c(CH3COO-) |
| c(CH3COOH) |
| 10-7×0.5b |
| 0.5(a-b) |
| 10-7b |
| a-b |
故答案为:
| 10-7b |
| a-b |
(4)①a、b、c、d、e五个点,a点是100mL0.1mol•L-1NH4HSO4溶液的PH,铵根离子水解显酸性,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,溶液中发生水解反应的离子是NH4+,NH4++H2O⇌NH3•H2O+H+,铵根离子水解溶液显酸性,
故答案为:NH4+;
②c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),则c点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
看了 化学平衡原理是中学化学学习的...的网友还看了以下: