早教吧作业答案频道 -->化学-->
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ
题目详情
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式___.
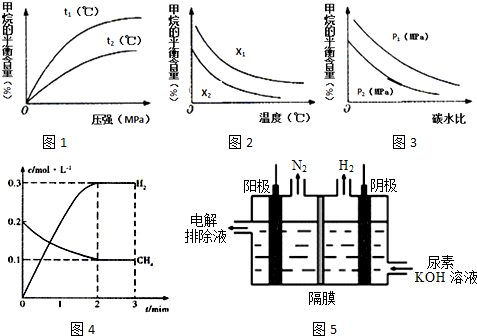
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图4所示.
3min时改变条件,反应进行到t1min时,体系中各物质的物质的量如下表所示:
则3~t1min之间,平衡向___(填“正”或“逆”)反应方向移动,3min时改变的条件是___.
(3)已知温度、压强和碳水比[
]对该反应的影响如图所示.
①图l中,两条曲线所示温度的关系:t1___t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1___x2.
③图3中,两条曲线所示压强的关系:p1___p2.
(4)氢气也可利用电解尿素制备.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图5图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为___.

(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式___.
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图4所示.
3min时改变条件,反应进行到t1min时,体系中各物质的物质的量如下表所示:
| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| t1 | 0.18 | 0.38 | 0.22 | 0.66 |
(3)已知温度、压强和碳水比[
| n(CH4) |
| n(H2O) |
①图l中,两条曲线所示温度的关系:t1___t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1___x2.
③图3中,两条曲线所示压强的关系:p1___p2.
(4)氢气也可利用电解尿素制备.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图5图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为___.
▼优质解答
答案和解析
(1)已知:①H2(g)+
O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+
O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1 kJ•mol-1;
(2)根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度t1<t2,故答案为:<;
②碳水比[
]值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>;
(4)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,
由图可知,阴极生成氢气,则阴极反应为6H2O+6e-═3H2↑+6OH-,总反应为CO(NH2)2+2KOH═K2CO3+N2↑+3H2↑,
故答案为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O.
| 1 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1 kJ•mol-1;
(2)根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度t1<t2,故答案为:<;
②碳水比[
| n(CH4) |
| n(H2O) |
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>;
(4)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,
由图可知,阴极生成氢气,则阴极反应为6H2O+6e-═3H2↑+6OH-,总反应为CO(NH2)2+2KOH═K2CO3+N2↑+3H2↑,
故答案为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O.
看了 工业上利用天然气(主要成分是...的网友还看了以下:
自由下落物体的高度h(米)与落下时间t(秒)的关系为h=4.9t的平方,一个铁球从19,6米高的建 2020-05-13 …
如图所示,图1为某二倍体植物细胞有丝分裂的某时期示意图,图2、图3为某动物(2n=4)减数分裂不同 2020-05-14 …
已知化合物A中各元素的质量分数分别为C:37.5%,H :4.2%,O:58.3%已知化合物A中各 2020-05-16 …
有人建议把H元素排在元素周期表的7主族.下列事实能支持这观点的是1.H原子得到一个电子就可以达到稳 2020-05-24 …
物理中的不确定问题△x△p≥h/4兀老师说其中的h/4兀可以直接写成h只是为什么呢? 2020-07-29 …
excel中这个公式如何用,=$H$2*E2+$H$3*E3+$H$4*E4+$H$5*E5+$H$ 2020-10-31 …
研究表明,人的ABO血型不仅由位于9号染色体上的IA、IB、i基因决定,还与位于第19号染色体上的H 2020-11-03 …
一物体从高空自由下落,其下落的高度h(m)与下落的时间t(s)之间的关系式是h=4.9t平方.(1) 2020-11-24 …
缕缕风,滴滴雨,滋润桃李(主题)-记我最尊敬的一位老师要求:1.要有主副标题2.写一位老师3.开头要 2020-12-06 …
ln0.4=?————谁能告诉我咋算的?(不用计算器啊)K=ESR/RR=[-(1-H+lnH)]已 2020-12-19 …