早教吧作业答案频道 -->化学-->
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+3
题目详情
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+
O2(g)⇌CO2(g)+2H2O(l)△H=-761kJ/mol;则CO(g)+2H2(g)⇌CH3OH(g)的△H=___.
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是___.
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是___.
A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
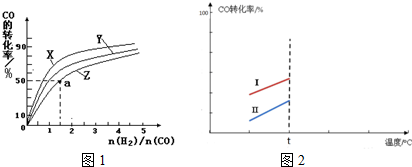
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律.图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线X对应的温度是___.
②利用图1中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+2H2(g)⇌CH3OH(g) 的平衡常数K=___.
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况.请在图2中补充t℃后的变化情况.
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+
| 3 |
| 2 |
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是___.
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是___.

A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律.图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线X对应的温度是___.
②利用图1中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+2H2(g)⇌CH3OH(g) 的平衡常数K=___.
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况.请在图2中补充t℃后的变化情况.
▼优质解答
答案和解析
(1)CO燃烧的热化学方程式:CO(g)+
O2(g)═CO2(g)△H=-283kJ•mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-761kJ•mol-1 ③
根据盖斯定律将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-90.8KJ•mol-1,
故答案为:-90.8 kJ/mol;
(2)A、反应前后质量和体积一直不变,所以密度一直不变,不能判断平衡,故A错误;
B、反应前后质量不变,但物质的量在变,所以平均相对分子质量保持不变,说明反应达平衡状态,故B正确;
C、生成CH3OH的速率与生成H2的速率等于系数之比,才能证明正逆反应速率相等,此时给定的条件不能判断平衡,故C错误;
D、CO体积分数保持不变,说明正逆反应速率相等,则反应达平衡状态,故D正确;
故选D;
(3)该可逆反应是反应前后气体体积减小的放热反应,
A.随时将CH3OH与反应混合物分离,平衡向正反应方向移动,但反应速率不变,故错误;
B.降低反应温度平衡向正反应方向移动,但反应速率减小,故错误;
C.恒容装置中充入H2,即增大体系压强,平衡向正反应方向移动且反应速率增大,故正确;
D.使用高效催化剂,反应速率增大,但平衡不移动,故错误;
故选C;
(4)①根据反应CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是300℃,
故答案是:300℃;
②该反应的平衡常数K=
,a点时,CO转化率50%,反应消耗了1mol×50%=0.5molCO,消耗氢气1mol,剩余n(H2)=1.5mol-1mol=0.5mol,生成0.5mol甲醇,a点各组分的浓度是:c(CH3OH)=0.25mol/L,c(CO)=0.25mol/L,c(H2)=0.25mol/L,
带人表达式得:K=
=16L2•mol-2,
故答案是:16;
(5)催化剂可以加快反应速率,但是不会引起化学平衡的移动,升高温度,化学平衡逆向移动,可以降低CO的转化率,t℃后的变化情况如下: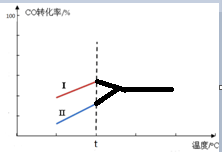 ,故答案为:
,故答案为: .
.
| 1 |
| 2 |
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
| 3 |
| 2 |
根据盖斯定律将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-90.8KJ•mol-1,
故答案为:-90.8 kJ/mol;
(2)A、反应前后质量和体积一直不变,所以密度一直不变,不能判断平衡,故A错误;
B、反应前后质量不变,但物质的量在变,所以平均相对分子质量保持不变,说明反应达平衡状态,故B正确;
C、生成CH3OH的速率与生成H2的速率等于系数之比,才能证明正逆反应速率相等,此时给定的条件不能判断平衡,故C错误;
D、CO体积分数保持不变,说明正逆反应速率相等,则反应达平衡状态,故D正确;
故选D;
(3)该可逆反应是反应前后气体体积减小的放热反应,
A.随时将CH3OH与反应混合物分离,平衡向正反应方向移动,但反应速率不变,故错误;
B.降低反应温度平衡向正反应方向移动,但反应速率减小,故错误;
C.恒容装置中充入H2,即增大体系压强,平衡向正反应方向移动且反应速率增大,故正确;
D.使用高效催化剂,反应速率增大,但平衡不移动,故错误;
故选C;
(4)①根据反应CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是300℃,
故答案是:300℃;
②该反应的平衡常数K=
| c(CH3OH) |
| c(CO)•c2(H2) |
带人表达式得:K=
| 0.25 |
| 0.25×0.252 |
故答案是:16;
(5)催化剂可以加快反应速率,但是不会引起化学平衡的移动,升高温度,化学平衡逆向移动,可以降低CO的转化率,t℃后的变化情况如下:
 ,故答案为:
,故答案为: .
.
看了 工业上一般以CO和H2为原料...的网友还看了以下:
窈窕淑女,君子好逑中的好是读hǎo还是hào呢窈窕淑女,君子好逑中的好是读hǎo还是hào原来一直 2020-05-22 …
为什么每mol水中含2molH-O键RT,水的共价键不是H-O-H吗,为什么会一摩水会含有二摩的H 2020-06-28 …
H-O-H,每mol水中含2molH-O键含2mol的H-O键,H-O-H中的H-O?H-O是什么 2020-06-28 …
您好,请问您知道以下内容出自那篇文章吗?水分子结构中的O—H键长和H—O—H键角的科学研究并未得到 2020-07-17 …
进制换算(213)D=()B=()H=()O(69.625)D=()D=()B=()O(127)D 2020-07-19 …
参与蛋白质分子中α-螺旋的氢键形成是A.每个肽键的N-H的H和其后第三个肽键的C=O的OB.每个肽 2020-07-21 …
某有机物由C,H,O三种元素组成,它的红外吸收光谱表明有羟基中O—H键和烃基中C—H键的红外某有机物 2020-11-25 …
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:(1)C、N、O三种元素第一电离能从大 2020-12-07 …
H、C、N、O是几种重要的非金属元素.回答以下问题:(1)C、N、O三种元素第一电离能从大到小的顺序 2020-12-07 …
下列说法正确的是()A.PCl5分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移B.两个 2021-01-02 …