早教吧作业答案频道 -->化学-->
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.(1)可用CO与H2合成甲醇(CH3OH),己知CO、CH3OH(1)、H2的燃烧热分别为:283.0kJ•mol-1、725.5KJ•mol-1、285.8kJ•mol-1,请写出
题目详情
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.
(1)可用CO与H2合成甲醇(CH3OH),己知CO、CH3OH(1)、H2的燃烧热分别为:28 3.0kJ•mol-1、725.5KJ•mol-1、285.8kJ•mol-1,请写出合成CH3OH(1)的热化学方程式___
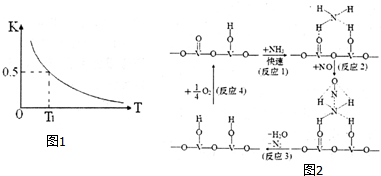
(2)反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g)在容积固定的密闭容器中进行,其平衡常数K与温度T的关系如图1所示.
①该反应是___(填“吸热”或“放热”)反应.
②一定条件下,下列能说明该反应达到平衡状态的是___.
a.混合气体的密度不再变化 b.容器内压强不再变化
c.v(CO2)=v(CO) d.CO在混合气中的质量分数保持不变
③T1温度下,加入FeO和CO,反应达平衡时CO的转化率为___.
(3)用V2O5作催化剂,NH3可将NO还原成N2,一种反应历程如图2所示.写出该反应化学方程式___.
(4)把含二氧化硫的工业烟气通入含Cr2O72-和Cr3+的酸性电镀废液中(Cr2O72-被还原为Cr3+),写出该反应的离子方程式___.反应一段时间后开始出现Cr(OH)3沉淀,用必要的离子方程式和文字,表述产生沉淀的原因___.

(1)可用CO与H2合成甲醇(CH3OH),己知CO、CH3OH(1)、H2的燃烧热分别为:28 3.0kJ•mol-1、725.5KJ•mol-1、285.8kJ•mol-1,请写出合成CH3OH(1)的热化学方程式___
(2)反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g)在容积固定的密闭容器中进行,其平衡常数K与温度T的关系如图1所示.
①该反应是___(填“吸热”或“放热”)反应.
②一定条件下,下列能说明该反应达到平衡状态的是___.
a.混合气体的密度不再变化 b.容器内压强不再变化
c.v(CO2)=v(CO) d.CO在混合气中的质量分数保持不变
③T1温度下,加入FeO和CO,反应达平衡时CO的转化率为___.
(3)用V2O5作催化剂,NH3可将NO还原成N2,一种反应历程如图2所示.写出该反应化学方程式___.
(4)把含二氧化硫的工业烟气通入含Cr2O72-和Cr3+的酸性电镀废液中(Cr2O72-被还原为Cr3+),写出该反应的离子方程式___.反应一段时间后开始出现Cr(OH)3沉淀,用必要的离子方程式和文字,表述产生沉淀的原因___.
▼优质解答
答案和解析
(1)CO、CH3OH(1)、H2的燃烧热分别为:28 3.0kJ•mol-1、725.5KJ•mol-1、285.8kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-725.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l),
该反应的反应热△H=-283.0kJ•mol-1+(-285.8kJ•mol-1)-
×(-725.5kJ•mol-1)=-129.1kJ•mol-1,即CO(g)+2H2(g)=CH3OH(l)△H=-129.1kJ•mol-1;
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-129.1kJ•mol-1;
(2)①图象甲中平衡常数曲线随温度升高而减小,说明正反应为放热反应,
故答案为:放热;
②FeO(s)+CO(g)⇌Fe(s)+CO2(g),反应前后是气体体积不变的放热反应,
a.在容积固定的密闭容器中进行,气体体积不变,气体质量发生变化,混合气体的密度不再变化,说明反应达到平衡状态,故a正确;
b.反应前后气体体积不变,容器内压强始终不发生变化,不能说明反应达到平衡状态,故b错误;
c.化学反应速率之比始终等于化学计量数之比,v(CO2)=v(CO),不能说明反应达平衡,故c错误;
d.CO在混合气中的质量分数保持不变,说明反应达平衡,故d正确;
故答案为:ad;
③T1温度下,向体积为V L的密闭容器中,加入FeO和CO,平衡常数为0.5,设一氧化碳起始量为x,变化量为y,FeO(s)+CO(g)⇌Fe(s)+CO2(g),
起始量 x 0
变化量 y y
平衡量 x-y y
平衡常数K=
=0.5,所以
=
,
二氧化碳转化率
=
=33.3%,
故答案为:33.3%;
(3)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2
4N2+6H2O,
故答案为:4NH3+4NO+O2
4N2+6H2O;
(4)根据题给信息反应物有二氧化硫和Cr2O72-,酸性电镀废液可提供氢离子,Cr2O72-被还原为Cr3+.根据氧化还原理论二氧化硫被氧化为SO42-配平即得离子方程式为3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O,Cr3+在水溶液中存在Cr3++3H2O⇌Cr(OH)3+3H+,上述反应消耗了H+使上述平衡正向移动,产生Cr(OH)3 沉淀,
故答案为:3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O;Cr3+在水溶液中存在Cr3++3H2O⇌Cr(OH)3+3H+,上述反应消耗了H+使上述平衡正向移动,产生Cr(OH)3 沉淀.
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
该反应的反应热△H=-283.0kJ•mol-1+(-285.8kJ•mol-1)-
| 2 |
| 3 |
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-129.1kJ•mol-1;
(2)①图象甲中平衡常数曲线随温度升高而减小,说明正反应为放热反应,
故答案为:放热;
②FeO(s)+CO(g)⇌Fe(s)+CO2(g),反应前后是气体体积不变的放热反应,
a.在容积固定的密闭容器中进行,气体体积不变,气体质量发生变化,混合气体的密度不再变化,说明反应达到平衡状态,故a正确;
b.反应前后气体体积不变,容器内压强始终不发生变化,不能说明反应达到平衡状态,故b错误;
c.化学反应速率之比始终等于化学计量数之比,v(CO2)=v(CO),不能说明反应达平衡,故c错误;
d.CO在混合气中的质量分数保持不变,说明反应达平衡,故d正确;
故答案为:ad;
③T1温度下,向体积为V L的密闭容器中,加入FeO和CO,平衡常数为0.5,设一氧化碳起始量为x,变化量为y,FeO(s)+CO(g)⇌Fe(s)+CO2(g),
起始量 x 0
变化量 y y
平衡量 x-y y
平衡常数K=
| y |
| x-y |
| y |
| x |
| 1 |
| 3 |
二氧化碳转化率
| y |
| x |
| 1 |
| 3 |
故答案为:33.3%;
(3)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2
| ||
故答案为:4NH3+4NO+O2
| ||
(4)根据题给信息反应物有二氧化硫和Cr2O72-,酸性电镀废液可提供氢离子,Cr2O72-被还原为Cr3+.根据氧化还原理论二氧化硫被氧化为SO42-配平即得离子方程式为3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O,Cr3+在水溶液中存在Cr3++3H2O⇌Cr(OH)3+3H+,上述反应消耗了H+使上述平衡正向移动,产生Cr(OH)3 沉淀,
故答案为:3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O;Cr3+在水溶液中存在Cr3++3H2O⇌Cr(OH)3+3H+,上述反应消耗了H+使上述平衡正向移动,产生Cr(OH)3 沉淀.
看了 环境污染影响人类生存,治理污...的网友还看了以下:
卫生湿巾的成分不同,对消毒有什么区别一种卫生湿巾里含有溴硝基丙二醇和苄索氯铵,而在另外一种湿巾里没有 2020-03-30 …
请问k*a^k,K^2*a^k极限如何求?0 2020-03-31 …
=k^2*100+(a+b)*k*10+ab.请问k与2之间那个叫什么号?代表什么? 2020-05-15 …
哪个单位有废甲醇?请问哪个单位有废甲醇或废醋酸钠,我们可以回收. 2020-05-16 …
询问有关乙醇和重铬酸钾反应的问题这个反应方程式怎么写?乙醇和重铬酸钾反应,氧化剂是重铬酸钾,还原剂 2020-05-17 …
下列各组混合物总物质的量不变时,各组分以任意比混合后,充分燃烧消耗O2的量不变的是( )A.乙烯, 2020-06-27 …
一道高一数学简单的问题,谢谢大家!所有与角a相同终边的角表示为k*360+a(k是实数)请问k是什么 2020-11-14 …
除去酯交换反应生成的乙醇请教各位大虾,酯交换反应生成的乙醇要怎么除去,因为乙醇会与产物反应,所以最好 2020-11-16 …
配制的氢氧化钾-乙醇标准液(0.05N)先用50ML水溶解后,加入的乙醇是无水乙醇还是95%的乙醇. 2020-12-03 …
老师,高代题!1.m×n矩阵D的行向量组所生成的F^n的子空间叫做()请问老师填n元行空间对么?2. 2020-12-04 …