早教吧作业答案频道 -->化学-->
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃
题目详情
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.

(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:___.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数的表达式是___,由表中数据判断△H___0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为___,则反应速率v(H2)=___.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)⇌CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式___.

(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:___.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为___,则反应速率v(H2)=___.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)⇌CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
| 1 |
| 2 |
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式___.
▼优质解答
答案和解析
(1)已知CH3OH(l)的燃烧热为-726.5kJ/mol,则CH3OH完全燃烧生成二氧化碳和液态水的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1;
(2)①平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积,则CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数的表达式K=
,升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:K=
;<;
②CO(g)+2H2(g)⇌CH3OH(g)
开始 1mol/L 3mol/L 0
转化 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=
=2.04,所以是250℃;反应速率v(H2)=
=0.4mol•L-1•min-1,故答案为:250℃;0.4mol•L-1•min-1;
(3)若在t1时刻将容器的体积缩小为原来的
,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动,至t2时刻又达到新的平衡,图示如下: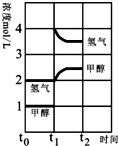 ;故答案为:
;故答案为: ;
;
(4)用CH3OH和空气作燃料电池,用KOH作电解质溶液,负极CH3OH失电子发生氧化反应,则负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
| 3 |
| 2 |
| 3 |
| 2 |
(2)①平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积,则CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数的表达式K=
| c(CH 3OH) |
| c(CO)•c 2(H 2) |
故答案为:K=
| c(CH 3OH) |
| c(CO)•c 2(H 2) |
②CO(g)+2H2(g)⇌CH3OH(g)
开始 1mol/L 3mol/L 0
转化 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=
| 0.8 |
| 0.2×1.4 2 |
| 1.6mol/L |
| 4min |
(3)若在t1时刻将容器的体积缩小为原来的
| 1 |
| 2 |
 ;故答案为:
;故答案为: ;
;(4)用CH3OH和空气作燃料电池,用KOH作电解质溶液,负极CH3OH失电子发生氧化反应,则负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
看了 煤的气化在煤化工业中占有重要...的网友还看了以下:
列方程解答下面两题.(1)一个周长是25.8米的长方形,长是9.6米,宽是多少米?(2)南京地铁一 2020-04-11 …
读某世界地理部分示意图,完成下列问题。小题1:图中A海域名称是A.红海B.地中海C.孟加拉湾D.波 2020-05-16 …
一根水泥柱子,埋在地下部分占全长的5分之一.地面部分长5米,水泥柱子全长多少米?埋在地下部分有多少 2020-06-02 …
两根水泥柱,埋入地下部分都是2分之1米,第一根露出地面的部分是全长的9分之7,第二第一根露出地面的 2020-07-20 …
读某日地球部分地区昼夜分布示意图(阴影部分表示黑夜).完成下列问题.(1)图示地区位于(南或北)半 2020-07-30 …
扫帚扫地的部分学名叫什么?我在写东西,可是我不知道该怎么称呼扫帚与地面接触的部分学名叫什么,还有它的 2020-11-15 …
南京地铁一号线地下部分大约长14.3千米,比地上部分的2倍少0.7千米.地上部分大约长多少千米?(用 2020-11-20 …
一个地铁南延线地下部分大约长12.7千米,地下部分比地上部分的2倍多2.1千米.地上大约长多少千米? 2020-11-21 …
岩石圈是内部圈层中比较特殊的一部分,是指()A.整个地壳B.地壳和地幔C.地壳和上地幔部分D.地壳和 2020-11-21 …
“地球部分地区昼夜分布示意图”中的阴影部分表示黑夜,其余部分表示白昼。读图回答问题。(1)据图判断, 2021-01-12 …