早教吧作业答案频道 -->化学-->
硫代硫酸钠晶体(Na2S2O3•5H2O,式量248)俗称海波或大苏打,它易溶于水,且溶解度随温度升高而显著增大,难溶于乙醇,加热时易分解,可用于照相行业的定影剂.实验室模拟工业制备硫
题目详情
硫代硫酸钠晶体(Na2S2O3•5H2O,式量248)俗称海波或大苏打,它易溶于水,且溶解度随温度升高而显著增大,难溶于乙醇,加热时易分解,可用于照相行业的定影剂.实验室模拟工业制备硫代硫酸钠晶体通常有以下方法,请回答有关问题.
亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3•5H2O,简易实验流程如下:
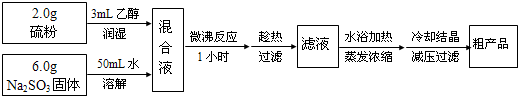
(1)硫粉用乙醇润湿的目的是___.
(2)操作中不能将溶液蒸发至干的原因是___.
(3)所得粗产品一般通过___方法提纯.
硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:
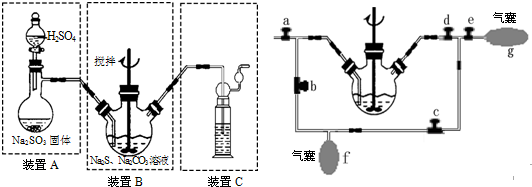
(4)装置C的作用是___.
(5)为充分利用SO2,对装置B进行改进(如上右图所示):当A中反应发生后,关闭旋塞b、e,打开a、c、d,往B中溶液通入SO2,未反应的SO2被收集到气囊f中.待f收集到较多气体时(假定此时装置A中反应已停止),关闭旋塞___,打开旋塞___,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中.再将g中的气体挤压入f中,如此反复,直至完全反应.
(6)为测定硫代硫酸钠晶体粗产品的纯度.某兴趣小组称取5.0克粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
①该产品的纯度是___.
②可能造成实验结果偏低的有___(填编号).
A.锥形瓶用蒸馏水润洗
B.滴定管未用Na2S2O3溶液润洗
C.滴定终点时俯视读数
D.若滴定前滴定管尖嘴处有气泡,滴定后消失.
亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3•5H2O,简易实验流程如下:

(1)硫粉用乙醇润湿的目的是___.
(2)操作中不能将溶液蒸发至干的原因是___.
(3)所得粗产品一般通过___方法提纯.
硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:

(4)装置C的作用是___.
(5)为充分利用SO2,对装置B进行改进(如上右图所示):当A中反应发生后,关闭旋塞b、e,打开a、c、d,往B中溶液通入SO2,未反应的SO2被收集到气囊f中.待f收集到较多气体时(假定此时装置A中反应已停止),关闭旋塞___,打开旋塞___,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中.再将g中的气体挤压入f中,如此反复,直至完全反应.
(6)为测定硫代硫酸钠晶体粗产品的纯度.某兴趣小组称取5.0克粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
| 滴定次数 | 1 | 2 | 3 |
| 消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
②可能造成实验结果偏低的有___(填编号).
A.锥形瓶用蒸馏水润洗
B.滴定管未用Na2S2O3溶液润洗
C.滴定终点时俯视读数
D.若滴定前滴定管尖嘴处有气泡,滴定后消失.
▼优质解答
答案和解析
(1)乙醇易溶于水,硫粉用乙醇润湿,有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率;
故答案为:有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率;
(2)已知硫代硫酸钠晶体加热易分解,故蒸干会使硫代硫酸钠脱水并分解,所以从硫代硫酸钠溶液中分离溶质时不能将溶液蒸发至干;
故答案为:蒸干会使硫代硫酸钠脱水并分解;
(3)硫代硫酸钠的溶解度随温度升高而显著增大,降低温度,采用重结晶法制取粗产品;
故答案为:重结晶;
(4)装置C主要是尾气处理,吸收反应生成的CO2和多余的SO2,防止污染大气,
故答案为:吸收反应生成的CO2和多余的SO2,防止污染大气;
(5)关闭旋塞a,打开旋塞c,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中;
故答案为:a;c;
(6)在锥形瓶中加入25mL 0.0lmol•L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+═3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-═2I-+S4O62-,
则可得关系式:IO3-~6S2O32-,
1mol 6mol
0.025L×0.0lmol•L-1 n(S2O32-)
则n(S2O32-)=0.0015mol,
第三次实验的数据误差较大,舍去,
所以250mL硫代硫酸钠溶液中硫代硫酸钠的物质的量为0.0015mol×
=0.01875mol,
则硫代硫酸钠的质量为0.01875mol×248g/mol=4.65g,
则该产品的纯度是
×100%=93%;
A.锥形瓶用蒸馏水润洗,对实验结果没影响,纯度不变,故A不选;
B.滴定管末用Na2S2O3溶液润洗,则Na2S2O3溶液会被稀释,所以测出硫代硫酸钠的质量偏小,故纯度偏小,故B选;
C.滴定终点时俯视读数,使Na2S2O3溶液体积偏小,计算出的硫代硫酸钠的质量偏大,故纯度偏大,故C不选;
D.滴定前滴定管尖嘴处有气泡,滴定后消失,使读出的Na2S2O3的体积变大,计算出原溶液中的硫代硫酸钠的质量偏小,则纯度偏小,故D选.
故答案为:93%;BD.
故答案为:有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率;
(2)已知硫代硫酸钠晶体加热易分解,故蒸干会使硫代硫酸钠脱水并分解,所以从硫代硫酸钠溶液中分离溶质时不能将溶液蒸发至干;
故答案为:蒸干会使硫代硫酸钠脱水并分解;
(3)硫代硫酸钠的溶解度随温度升高而显著增大,降低温度,采用重结晶法制取粗产品;
故答案为:重结晶;
(4)装置C主要是尾气处理,吸收反应生成的CO2和多余的SO2,防止污染大气,
故答案为:吸收反应生成的CO2和多余的SO2,防止污染大气;
(5)关闭旋塞a,打开旋塞c,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中;
故答案为:a;c;
(6)在锥形瓶中加入25mL 0.0lmol•L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+═3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-═2I-+S4O62-,
则可得关系式:IO3-~6S2O32-,
1mol 6mol
0.025L×0.0lmol•L-1 n(S2O32-)
则n(S2O32-)=0.0015mol,
第三次实验的数据误差较大,舍去,
所以250mL硫代硫酸钠溶液中硫代硫酸钠的物质的量为0.0015mol×
| 250 | ||
|
则硫代硫酸钠的质量为0.01875mol×248g/mol=4.65g,
则该产品的纯度是
| 4.65g |
| 5.0g |
A.锥形瓶用蒸馏水润洗,对实验结果没影响,纯度不变,故A不选;
B.滴定管末用Na2S2O3溶液润洗,则Na2S2O3溶液会被稀释,所以测出硫代硫酸钠的质量偏小,故纯度偏小,故B选;
C.滴定终点时俯视读数,使Na2S2O3溶液体积偏小,计算出的硫代硫酸钠的质量偏大,故纯度偏大,故C不选;
D.滴定前滴定管尖嘴处有气泡,滴定后消失,使读出的Na2S2O3的体积变大,计算出原溶液中的硫代硫酸钠的质量偏小,则纯度偏小,故D选.
故答案为:93%;BD.
看了 硫代硫酸钠晶体(Na2S2O...的网友还看了以下:
将5克固体氢氧化钠完全溶解在50克溶质质量分数为12%的氢氧化钠溶液中,求:(1)所得溶液的溶质质 2020-04-09 …
如何从硫代硫酸钠水溶液中提取大苏打?大苏打是硫代硫酸钠的俗名,又叫海波(Hypo的音译),带有五个 2020-05-16 …
2、将4gNaOH固体溶于水配成250mL溶液,1)求此溶液中NaOH的物质的量浓度.2)取出10 2020-05-16 …
氯化钠在20℃时的溶解度为36克.则20℃时,氯化钠饱和溶液中溶质、溶剂、溶液之间的质量比正确的是 2020-07-17 …
电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O通电.2H2↑+O2↑.电解一定质量氢氧化钠稀 2020-07-21 …
将一定量的碳酸钠粉末溶于131克水中配成溶液,向其中加入146克盐酸,恰好完全反应,并放出气体11 2020-07-29 …
假若有一瓶室温下长期密封放置的氯化钠稀溶液,请你分析下列说法正确的是()A.接近瓶口的溶液较稀B.瓶 2020-11-10 …
假若有一瓶室温下长期密封放置的氯化钠稀溶液,请你分析下列说法正确的是()A.接近瓶口的溶液较稀B.瓶 2021-01-01 …
碳酸钠和碳酸氢钠的固体混合物充分加热至恒重,其质量变化如图所示.另取相同质量的该混合物溶于水得到56 2021-02-09 …
1.在20℃时,将250g氯化钠饱和溶液加热蒸发掉30g水,再冷却到20℃时,有10.8氯化钠晶体析 2021-02-11 …