早教吧作业答案频道 -->化学-->
天然气(以甲烷计)在工业生产中用途广泛.Ⅰ.在制备合成氨原料气H2中的应用(1)甲烷蒸气转化法制H2的主要转化反应如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2kJ/molCH4(g)+2H2O(
题目详情
天然气(以甲烷计)在工业生产中用途广泛.
Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2 kJ/mol
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0 kJ/mol
上述反应所得原料气中的CO能使合成氨催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是___.
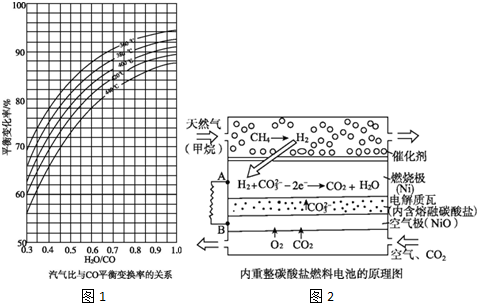
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如图1所示:
析图可知:
①相同温度时,CO平衡变换率与汽气比的关系是___.
②汽气比相同时,CO平衡变换率与温度的关系是___.
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为Kp=___.随温 度的降低,该平衡常数___(填“增大”“减小”或“不变”).
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图2如下:
(1)外电路电子流动方向:由___流向___(填字母).
(2)空气极发生反应的离子方程式是___.
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e-转移,有___ g 精铜析出.

Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2 kJ/mol
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0 kJ/mol
上述反应所得原料气中的CO能使合成氨催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是___.
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如图1所示:
析图可知:
①相同温度时,CO平衡变换率与汽气比的关系是___.
②汽气比相同时,CO平衡变换率与温度的关系是___.
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为Kp=___.随温 度的降低,该平衡常数___(填“增大”“减小”或“不变”).
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图2如下:
(1)外电路电子流动方向:由___流向___(填字母).
(2)空气极发生反应的离子方程式是___.
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e-转移,有___ g 精铜析出.
▼优质解答
答案和解析
Ⅰ.(1)①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2kJ/mol
②CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0kJ/mol
依据盖斯定律计算②-①得到:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ/mol;
故答案为:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ/mol;
(2)①依据图象曲线变化分析可知,温度一定,汽气比越大CO平衡变化率越大;
故答案为:汽气比越大CO平衡变化率越大;
②汽气比相同时,图象分析可知,CO平衡变换率与温度的关系是,温度越高,CO平衡变化率越小;
故答案为:温度越高CO平衡变化率越小;
(3)CH4(g)+H2O(g)⇌CO(g)+3H2(g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=
;反应是放热反应,升高温度平衡向吸热反应方向移动,平衡逆向进行,平衡常数增大;
故答案为:
; 增大;
Ⅱ.(1)原电池原理分析,电子流向是从负极流向正极,装置中A为负极,B为正极,所以外电路电子流向为A流向B;
故答案为:A;B;
(2)原电池正极上的电极反应式为O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
(3)电解精炼铜,阴极上铜离子得到电子生成铜,电极反应Cu2++2e-=Cu,当电路有0.6mol e-转移反应生成铜0.3mol,质量=0.3mol×64g/mol=19.2 g;
故答案为:19.2.
②CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0kJ/mol
依据盖斯定律计算②-①得到:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ/mol;
故答案为:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ/mol;
(2)①依据图象曲线变化分析可知,温度一定,汽气比越大CO平衡变化率越大;
故答案为:汽气比越大CO平衡变化率越大;
②汽气比相同时,图象分析可知,CO平衡变换率与温度的关系是,温度越高,CO平衡变化率越小;
故答案为:温度越高CO平衡变化率越小;
(3)CH4(g)+H2O(g)⇌CO(g)+3H2(g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=
| P(CO2)•P(H2) |
| P(CO)•P(H2O) |
故答案为:
| P(CO2)•P(H2) |
| P(CO)•P(H2O) |
Ⅱ.(1)原电池原理分析,电子流向是从负极流向正极,装置中A为负极,B为正极,所以外电路电子流向为A流向B;
故答案为:A;B;
(2)原电池正极上的电极反应式为O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
(3)电解精炼铜,阴极上铜离子得到电子生成铜,电极反应Cu2++2e-=Cu,当电路有0.6mol e-转移反应生成铜0.3mol,质量=0.3mol×64g/mol=19.2 g;
故答案为:19.2.
看了 天然气(以甲烷计)在工业生产...的网友还看了以下:
物质的性质决定用途,用途反映性质.请将下列物质与对应的性质和用途用直线连接氧气固态易升华吸热支持液 2020-04-11 …
物质的性质决定用途,用途反映性质.请将下列物质与对应的性质和用途用直线连接氧气固态易升华吸热支持液 2020-04-11 …
物质的性质决定用途,用途反映性质.下列用途由化学性质决定的是()A.干冰用于人工降雨B.用氦气填充 2020-04-11 …
关于化学反应的△H的理解正确的是()A.△H>0的反应是吸热反应B.△H=ΣH(反应物)-ΣH(生 2020-04-11 …
关于化学反应的△H的理解正确的是()A、△H>0的反应是吸热反应B、△H=ΣH(反应物)-ΣH(生 2020-04-11 …
按要求写出下列反应的化学方程式,并说明该反应在实际中一种用途反应化学方程式用途木炭在空气中燃烧双氧 2020-05-13 …
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可 2020-05-13 …
焓变指的是H(反应产物)—H(反应物)可是为什么又会等于反应前物质的总键能减去反应后的物质的总键能 2020-06-07 …
(2008•梅州)A、B、C、D、E、F、H、I、M为初中化学常见的物质,且有下图所示的转化关系.已 2020-11-12 …
化学在日常生活中有非常重要的用途,物质的性质往往决定用途,而用途反映出物质的性质.请写出下列应用的化 2021-01-24 …