早教吧作业答案频道 -->化学-->
铁及其化合物有重要用途.(1)①FeS04可转化为FeCO3,FeC03在空气中加热反应可制得铁系氧化物材料.己知25℃,lOlkPa时:4Fe(s)+3O2(g)═2Fe203(s)△H=-1648kJ•mol-1C(s)+02(g)═CO2(g)
题目详情
铁及其化合物有重要用途.
(1)①FeS04可转化为FeCO3,FeC03在空气中加热反应可制得铁系氧化物材料.
己知 25℃,lOlkPa时:
4Fe(s)+3O2(g)═2Fe203(s)△H=-1648kJ•mol-1
C(s)+02(g)═CO2(g)△H=-393kJ•mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=-1480kJ•mol-1
①Fe03在空气中加热反应生成Fe203的热化学方程式是___
②FeS04在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是___
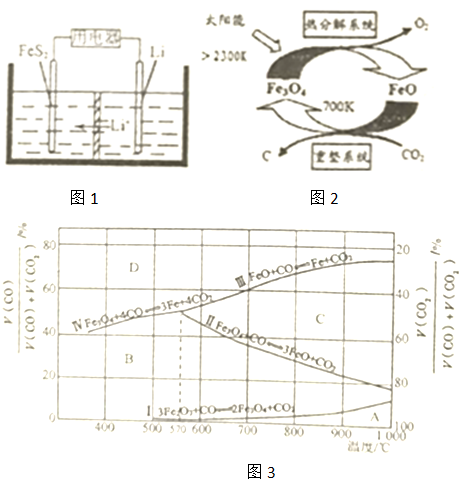
(2)铁的氧化物应用于由CO2制取C的太阳能工艺中,如图1所示
①“热分解系统”发生的反应为2Fe304═6Fe0+02↑,每分解1molFe304转移电子的物质的量为___
②“重整系统”发生反应的化学方程式为___
(3)Fe203用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图2所示.
(图3中I、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的:A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的冈域)
①800℃时’混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为___
②据图分析,下列说法正确的是___(填字母).
A.温度低于570℃时,Fe203还原焙烧的产物中不含FeO
B.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
C.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率.

(1)①FeS04可转化为FeCO3,FeC03在空气中加热反应可制得铁系氧化物材料.
己知 25℃,lOlkPa时:
4Fe(s)+3O2(g)═2Fe203(s)△H=-1648kJ•mol-1
C(s)+02(g)═CO2(g)△H=-393kJ•mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=-1480kJ•mol-1
①Fe03在空气中加热反应生成Fe203的热化学方程式是___
②FeS04在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是___
(2)铁的氧化物应用于由CO2制取C的太阳能工艺中,如图1所示
①“热分解系统”发生的反应为2Fe304═6Fe0+02↑,每分解1molFe304转移电子的物质的量为___
②“重整系统”发生反应的化学方程式为___
(3)Fe203用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图2所示.
(图3中I、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的:A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的冈域)
①800℃时’混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为___
②据图分析,下列说法正确的是___(填字母).
A.温度低于570℃时,Fe203还原焙烧的产物中不含FeO
B.温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
C.Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率.
▼优质解答
答案和解析
(1)①发生反应:4FeCO3+O2
2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
②电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,
故答案为:FeS2+4e-=Fe+2S2-;
(2)①反应2Fe3O4
6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2molFe3O4参加反应,生成1mol氧气,转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol,
故答案为:2mol;
②由示意图可知,重整系统中CO2和FeO反应生成Fe3O4和C,反应的方程式为6FeO+CO2═2Fe3O4+C,
故答案为:6FeO+CO2═2Fe3O4+C;
(3)①800℃时,混合气体中CO2体积分数为40%时,由图可知,“800℃、CO2体积分数为40%”时,在C区,此时为FeO的稳定区域,故产物为FeO,Fe2O3用CO还原得到氧化亚铁和一氧化碳,反应的化学方程式为:Fe2O3+CO
2FeO+CO2,
故答案为:Fe2O3+CO
2FeO+CO2;
②A.由图可知,FeO在C区稳定,对应的温度高于570℃,故A正确;
B.铁元素的质量分数由高到低为:Fe>FeO>Fe3O4>Fe2O3,对于反应II知,升高温度时,CO2的质量分数减小,即升温平衡逆向移动,FeO转化成Fe3O4,F铁元素的质量分数减小,所以含量不仅与T有关,还与CO气体的比例有关,故B错误;
C.分离CO2可使四个反应的平衡均正向移动,有利于Fe含量的增加,故C正确,
故答案为:AC.
| ||
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
②电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,
故答案为:FeS2+4e-=Fe+2S2-;
(2)①反应2Fe3O4
| ||
故答案为:2mol;
②由示意图可知,重整系统中CO2和FeO反应生成Fe3O4和C,反应的方程式为6FeO+CO2═2Fe3O4+C,
故答案为:6FeO+CO2═2Fe3O4+C;
(3)①800℃时,混合气体中CO2体积分数为40%时,由图可知,“800℃、CO2体积分数为40%”时,在C区,此时为FeO的稳定区域,故产物为FeO,Fe2O3用CO还原得到氧化亚铁和一氧化碳,反应的化学方程式为:Fe2O3+CO
| ||
故答案为:Fe2O3+CO
| ||
②A.由图可知,FeO在C区稳定,对应的温度高于570℃,故A正确;
B.铁元素的质量分数由高到低为:Fe>FeO>Fe3O4>Fe2O3,对于反应II知,升高温度时,CO2的质量分数减小,即升温平衡逆向移动,FeO转化成Fe3O4,F铁元素的质量分数减小,所以含量不仅与T有关,还与CO气体的比例有关,故B错误;
C.分离CO2可使四个反应的平衡均正向移动,有利于Fe含量的增加,故C正确,
故答案为:AC.
看了 铁及其化合物有重要用途.(1...的网友还看了以下:
(1)幂函数y=x^-2/3的定义域?(2)若函数y=f(x)的反函数图象过点(1,5),则函数y 2020-05-13 …
在一定条件下,一个密闭容器内发生某反应测得反应过程中各物质得质量部分数据如下下列未知数据正确是物质 2020-05-16 …
在反应2A+B=3C+D中,A、B相对分子质量比为5:1在反应2A+B=3C+D中,A和B的相对分 2020-05-16 …
有A,B,C,D4种硅元素物质,能发生如下反应:1.C与烧碱溶液反应生成A与水2.A溶液与钙盐发生 2020-06-27 …
A+B=C+D中,10克A和20克B恰好反应生成5克C,若反应生成5克D,参加反应的A为()克.能 2020-06-28 …
将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D( 2020-07-08 …
已知a,b,c为有理数,且它们在数轴上的位置如图所示.(1)试判断a,b,c的正负性;(2)在数轴 2020-07-18 …
在三角形中,已知a=7,b=5.C=45度,求c,A,B.(用反三角函数表示)在三角形中,已知a= 2020-08-03 …
高二化学平衡1.将等物质的量的A,B混合于2L的密闭容器中,发生如下反应:3A(气)+B(气)=xC 2020-11-03 …
平面直角坐标系中有六个点A(1,5)B(-3/,-3/5)C(-5,-1)D(-2,5/2)E(3, 2020-12-25 …