肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是()A.194B.39
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )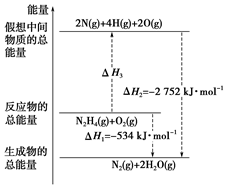
A. 194
B. 391
C. 516
D. 685
化学反应中,旧键断裂吸收能量,设断裂1molN-H键所需的能量为x,则旧键断裂吸收的能量=154+4x+500=2218,解得:x=391,
故选B.
有一条长为7.2米的木料,做成如图所示的”目“字形的窗框,窗的高和宽各取多少米时,这个窗的面积最大? 2020-03-31 …
从冰箱中取出饮料放置在室内,饮料的温度随时间变化的.图象如图所示.从图中可知,第20min时,饮料 2020-05-12 …
阅读材料,回答问题材料一《三国鼎立形势图》如图1所示材料二丝绸之路示意图。如图2所示(1)材料一中 2020-05-13 …
如图所示,有一块块形状不规则的木料,只有AB一边成直线,木工师傅要在此木料上截出一块有一组对边平行 2020-05-17 …
阅读下列材料:材料一如图所示材料二国以民为本,民以衣食为本,衣食以农桑为本。--元世祖材料三(元朝 2020-06-11 …
如图是用动滑轮运送建筑材料A的示意图,在卷扬机对绳子的拉力作用下,使重800N的建筑材料A在50s 2020-06-12 …
下列为四类植物的特征资料,表中“+”表示有,“-”表示没有.根、茎、叶花果实种子A+--+B+-- 2020-06-12 …
阅读下面材料.阅读下面材料:已知点A.B在数轴上分别表示有理数a.b,A.B两点之间的距离表示为| 2020-06-23 …
请阅读如图后回答材料一如图1所示材料二如图2所示材料三如图3所示(1)材料一反映的情形,是因为当时 2020-07-03 …
阅读材料:我们知道,若点A、B在数轴上分别表示有理数a、b,A、B两点间的距离表示为AB.则AB= 2020-07-13 …