早教吧作业答案频道 -->化学-->
已知CO2可以生产绿色燃料甲醇,反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H=-187.4KJ/mol,300℃时,密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答
题目详情
已知CO2可以生产绿色燃料甲醇,反应如下:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H=-187.4KJ/mol,300℃时,密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:
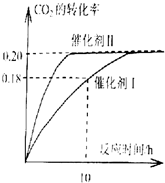
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)=___.
(2)下列叙述正确的是___.
A.汽容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充人氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂Ⅱ比催化剂I高
D.催化效率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高
(3)根椐图中数据,计算此反应在.300℃时的平衡常数.(写出计箅过程)
(4)将上述平衡体系升温至400℃,平衡常数:K(400℃)___ K(300℃)(填<、=或>).
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-242.8KJ/mol
则反应2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H=___.
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H=-187.4KJ/mol,300℃时,密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:

(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)=___.
(2)下列叙述正确的是___.
A.汽容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充人氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂Ⅱ比催化剂I高
D.催化效率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高
(3)根椐图中数据,计算此反应在.300℃时的平衡常数.(写出计箅过程)
(4)将上述平衡体系升温至400℃,平衡常数:K(400℃)___ K(300℃)(填<、=或>).
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-242.8KJ/mol
则反应2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H=___.
▼优质解答
答案和解析
(1)用催化剂I时,反应在10小时内二氧化碳的转化率为0.18,二氧化碳的浓度变化为:1.00mol•L-1×0.18=0.18mol/L,则反应在10小时内二氧化碳的平均反应速率为:v(CO2)=
=0.018mol•(L•h)-1,则v(H2)=3v(CO2)=0.054mol•(L•h)-1,
故答案为:0.054mol•(L•h)-1;
(2)A、该反应前后气体的质量不变,容器的容积固定,所以混合气体的密度始终不变,故当容器内气体的密度不再改变时,反应不一定达到平衡状态,故A正确;
B、充入氩气增大压强,但是反应体系中各组分的浓度不变,化学平衡不发生移动,所以CO2的转化率不变,故B错误;
C、催化剂不影响化学平衡,所以CO2平衡转化率在上述反应条件下,催化剂Ⅱ与催化剂Ⅰ的转化率相等,故C错误;
D、在上述反应条件下,催化剂Ⅱ的反应速率大于催化剂Ⅰ的,说明催化剂Ⅱ比催化剂Ⅰ的催化效率高,故D正确;
故选AD;
(3)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始浓度(mol/L)1.00 1.60 0 0
变化浓度(mol/L)0.20 0.60 0.20 0.20
平衡浓度(mol/L)0.80 1.0 0.20 0.20
K=
=
=0.050L2•mol-2,
答:300℃时的平衡常数为0.050 L2•mol-2;
(4)由于该反应为放热反应,温度增大,化学平衡向着逆向移动,反应物浓度减小,生成物浓度增大,化学平衡常数增大,故平衡常数K(400℃)<K(300℃),
故答案为:<;
(5)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-187.4kJ•mol-1①
2H2(g)+O2(g)=2H2O(g)△H=-242.8kJ•mol-1②
由盖斯定律:②×3-①×2可得:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g);△H=(-242.8kJ•mol-1)×3-(-187.4kJ•mol-1)×2=-353.6kJ•mol-1
故答案为:-353.6kJ•mol-1.
| 0.18mol/L |
| 10h |
故答案为:0.054mol•(L•h)-1;
(2)A、该反应前后气体的质量不变,容器的容积固定,所以混合气体的密度始终不变,故当容器内气体的密度不再改变时,反应不一定达到平衡状态,故A正确;
B、充入氩气增大压强,但是反应体系中各组分的浓度不变,化学平衡不发生移动,所以CO2的转化率不变,故B错误;
C、催化剂不影响化学平衡,所以CO2平衡转化率在上述反应条件下,催化剂Ⅱ与催化剂Ⅰ的转化率相等,故C错误;
D、在上述反应条件下,催化剂Ⅱ的反应速率大于催化剂Ⅰ的,说明催化剂Ⅱ比催化剂Ⅰ的催化效率高,故D正确;
故选AD;
(3)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始浓度(mol/L)1.00 1.60 0 0
变化浓度(mol/L)0.20 0.60 0.20 0.20
平衡浓度(mol/L)0.80 1.0 0.20 0.20
K=
| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
| 0.20mol/L×0.20mol/L |
| 0.80mol/L×(1.0mol/L)3 |
答:300℃时的平衡常数为0.050 L2•mol-2;
(4)由于该反应为放热反应,温度增大,化学平衡向着逆向移动,反应物浓度减小,生成物浓度增大,化学平衡常数增大,故平衡常数K(400℃)<K(300℃),
故答案为:<;
(5)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-187.4kJ•mol-1①
2H2(g)+O2(g)=2H2O(g)△H=-242.8kJ•mol-1②
由盖斯定律:②×3-①×2可得:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g);△H=(-242.8kJ•mol-1)×3-(-187.4kJ•mol-1)×2=-353.6kJ•mol-1
故答案为:-353.6kJ•mol-1.
看了 已知CO2可以生产绿色燃料甲...的网友还看了以下:
如图所示,所使用的杠杆属于费力杠杆的是()A.钓鱼竿B.开瓶器C.灭火器压把D.钢丝钳 2020-06-20 …
关于闭合电路的欧姆定律电容器C1=6μF、C2=3μF,电阻R1=6Ω、R2=3Ω.试求:(1)当 2020-06-27 …
如图所示,所使用的杠杆属于费力杠杆的是()A.钓鱼竿B.开瓶器C.灭火器压把D.钢丝钳 2020-07-12 …
平行板电容器C与三个可变电阻器R1、R2、R3以及电源连成如图所示的电路.闭合开关S待电路稳定后,电 2020-11-03 …
如图所示,用开瓶器在A处用力开启瓶盖.则()A.B点为开瓶器的支点B.开瓶器受到的阻力方向为竖直向上 2020-11-10 …
如图所示的四个实例中,目的是为了增大摩擦的是()A.给车轴加润滑油B.开瓶器C.给木箱装上轮子D.磁 2020-12-02 …
下列有关“北京人”(如图)的陈述正确的一项是()A.开始使用天然火B.开始使用磨制石器C.开始烧制陶 2020-12-07 …
如图所示,有一个由电池、电阻和电容器组成的电路,当把电容器的两块极板错开一定位置时,在错开的过程中( 2020-12-07 …
如图所示,E=10V,r=1Ω,R1=3Ω,R2=6Ω,C=30μF,求:(1)闭合K,电路稳定后电 2020-12-20 …
如图,平行板电容器C充电后,断开电键K,一电子以垂直电场方向的初速度v0飞过平行板电容器,在电场方向 2021-01-02 …