早教吧作业答案频道 -->化学-->
为解决能源短缺问题,工业生产中应合理利用化学能.(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式(2)如
题目详情
为解决能源短缺问题,工业生产中应合理利用化学能.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式___
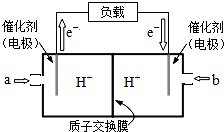
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图.
放电时甲醇应从___处通入(填“a”或“b”),电池内部H+向___(填“左”或“右”)移动.写出电池负极的电极反应式___.
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.
已知:N2(g)+3H2(g)═2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据计算a 的数值___
(4)已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.

(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式___
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图.
放电时甲醇应从___处通入(填“a”或“b”),电池内部H+向___(填“左”或“右”)移动.写出电池负极的电极反应式___.
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
(4)已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.
▼优质解答
答案和解析
(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,甲醇在负极上发生氧化反应,氢离子移向正极右侧,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:a;右;CH3OH-6e-+H2O=CO2+6H+;
(3)N2(g)+3H2(g)⇌2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-akJ•mol-1×6=-93kJ•mol-1,a=391 kJ•mol-1,故答案为:391;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×
-③×
可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+
×(-571.6kJ/mol)-
×(-2599 kJ/mol)=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,甲醇在负极上发生氧化反应,氢离子移向正极右侧,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:a;右;CH3OH-6e-+H2O=CO2+6H+;
(3)N2(g)+3H2(g)⇌2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-akJ•mol-1×6=-93kJ•mol-1,a=391 kJ•mol-1,故答案为:391;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×
| 1 |
| 2 |
| 1 |
| 2 |
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:+226.7kJ•mol-1.
看了 为解决能源短缺问题,工业生产...的网友还看了以下:
如图为探究吲哚乙酸对月季插条生根作用的结果.有关实验的分析和评价,错误的是()A.对照组的实验目的 2020-05-13 …
“我”是怎样从脱险中获得“走一步再走一步”这样的人生经验的?它对“我”有何影响? 2020-05-17 …
小明同学所在的实验小组在做实验时需要一个电源,但已有的一个电源上的正负极模糊不清,请你用所学的物理 2020-05-20 …
仿写,有才华的人请进呀语文是一望无际的蒹葭苍苍,是珠落玉盘的琵琶,是诸葛孔明的锦囊妙计,是用自己美 2020-06-10 …
写作(30分)“问渠那得清如许,为有源头活水来。”生活就是写作的源泉。让我们感受生活,收获灵感,说 2020-06-21 …
德国在处理城市垃圾,实现垃圾资源化的过程中,值得我们借鉴的经验是A.填埋和焚烧B.生产新能源和有机 2020-06-22 …
六年级一班有25名男生,25名女生;二班有30名男生,20名女生.测验的优秀率如下:一班男生为84 2020-06-27 …
学生实验的一般步骤有:①及时记录,认真填写实验报告;②预习实验内容;③按实验步骤进行操作,观察分析 2020-07-04 …
打点计时器是一种计时仪器,由学生实验电源供电,工作电压4~6伏,当电源的频率是50赫兹时,打出的相 2020-07-06 …
温特实验证明了()A.生长素只能从形态学上端运输到形态学下端B.造成胚芽鞘弯曲的刺激是某种化学物质 2020-07-15 …