早教吧作业答案频道 -->化学-->
肼(N2H4)是重要的化工原料.N2H4能与水、乙醇等混溶;N2H4的沸点是113.5℃;N2H4是二元弱碱,在水中的电力方式与氨相似;在碱性溶液中,N2H4是强还原剂.某学习小组用尿素溶液和NaOH、NaClO
题目详情
肼(N2H4)是重要的化工原料.N2H4能与水、乙醇等混溶;N2H4的沸点是113.5℃;N2H4是二元弱碱,在水中的电力方式与氨相似;在碱性溶液中,N2H4是强还原剂.某学习小组用尿素溶液和NaOH、NaClO的混合溶液反应制取水合肼(N2H4•H2O),反应方程式为:CO(NH2O)2O+2NaOH+NaClO═Na2OCO3+N2OH4•H2OO+NaCl.
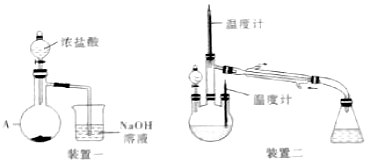
回答下列问题:
(1)N2H4的电子式为___;N2H4在水中的第一步电离方程式为___
(2)用图的装置一制备NaClO溶液(夹持装置已省略):
①装置一中仪器A的名称为___
②仪器A里盛放的药品为KMnO4,KMnO4和浓盐酸反应的离子方程式为___
(3)用图的装置二制备水合肼(夹持装置已省略):
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.然后加快三颈烧瓶内的溶液,收集108-114℃馏分.
①三颈烧瓶所盛溶液中溶质的化学式为___
②制备水合肼的关键之一是控制NaClO溶液不能过量,否则N2H4•H2O和NaClO发生反应,产物之一是无色无味、性质稳定的单质气体,则反应的化学方程式为___
③测定馏分中水合肼(N2H4•H2O)的质量分数:称取馏分1.00g,加入适量NaHCO3固体,加水配成250mL溶液,取25.00mL,用0.1000mol•L-1的I2溶液滴定,用淀粉作指示剂,达到滴定终点时的现象为___.实验测得消耗I2溶液的平均值为36.00mL,则馏分中水合肼(N2H4•H2O)的质量分数为___.(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)

回答下列问题:
(1)N2H4的电子式为___;N2H4在水中的第一步电离方程式为___
(2)用图的装置一制备NaClO溶液(夹持装置已省略):
①装置一中仪器A的名称为___
②仪器A里盛放的药品为KMnO4,KMnO4和浓盐酸反应的离子方程式为___
(3)用图的装置二制备水合肼(夹持装置已省略):
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.然后加快三颈烧瓶内的溶液,收集108-114℃馏分.
①三颈烧瓶所盛溶液中溶质的化学式为___
②制备水合肼的关键之一是控制NaClO溶液不能过量,否则N2H4•H2O和NaClO发生反应,产物之一是无色无味、性质稳定的单质气体,则反应的化学方程式为___
③测定馏分中水合肼(N2H4•H2O)的质量分数:称取馏分1.00g,加入适量NaHCO3固体,加水配成250mL溶液,取25.00mL,用0.1000mol•L-1的I2溶液滴定,用淀粉作指示剂,达到滴定终点时的现象为___.实验测得消耗I2溶液的平均值为36.00mL,则馏分中水合肼(N2H4•H2O)的质量分数为___.(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)
▼优质解答
答案和解析
(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,其电子式为: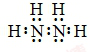 ,联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2O⇌N2H5++OH-;
,联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2O⇌N2H5++OH-;
故答案为: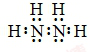 ;N2H4+H2O⇌N2H5++OH-;
;N2H4+H2O⇌N2H5++OH-;
(2)①仪器A为蒸馏烧瓶;
故答案为:蒸馏烧瓶;
②KMnO4和浓盐酸反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)①三颈烧瓶所盛溶液中为尿素,化学式为:CO(NH2)2;
故答案为:CO(NH2)2;
②N2H4•H2O和NaClO发生反应,产物之一是无色无味、性质稳定的单质气体,说明生成氮气,氮元素化合价升高,则氯元素化合价降低生成氯化钠,则化学方程式为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
故答案为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
③由N2H4•H2O+2I2=N2↑+4HI+H2O,用淀粉作指示剂,达到滴定终点时的现象为当滴入最后一滴I2溶液时,可知250ml溶液中含有水合肼的物质的量=0.100mol/L×0.036L×
×
=0.018mol,水合肼(N2H4•H2O)的质量分数=
=90.0%;
故答案为:当滴入最后一滴I2溶液时,溶液有无色变成蓝色,且半分钟内不褪色;90.0%.
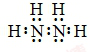 ,联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2O⇌N2H5++OH-;
,联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2O⇌N2H5++OH-;故答案为:
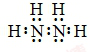 ;N2H4+H2O⇌N2H5++OH-;
;N2H4+H2O⇌N2H5++OH-;(2)①仪器A为蒸馏烧瓶;
故答案为:蒸馏烧瓶;
②KMnO4和浓盐酸反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)①三颈烧瓶所盛溶液中为尿素,化学式为:CO(NH2)2;
故答案为:CO(NH2)2;
②N2H4•H2O和NaClO发生反应,产物之一是无色无味、性质稳定的单质气体,说明生成氮气,氮元素化合价升高,则氯元素化合价降低生成氯化钠,则化学方程式为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
故答案为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
③由N2H4•H2O+2I2=N2↑+4HI+H2O,用淀粉作指示剂,达到滴定终点时的现象为当滴入最后一滴I2溶液时,可知250ml溶液中含有水合肼的物质的量=0.100mol/L×0.036L×
| 1 |
| 2 |
| 250 |
| 25 |
| 0.018mol×50g/mol |
| 1g |
故答案为:当滴入最后一滴I2溶液时,溶液有无色变成蓝色,且半分钟内不褪色;90.0%.
看了 肼(N2H4)是重要的化工原...的网友还看了以下:
1、不能发生离子反应的是A、NA2CO3溶液与稀盐酸B、CUSO4溶液与BACL2溶液C、H2SO 2020-04-27 …
下列物质的量浓度关系错误的是()A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c 2020-05-13 …
为什么有的试剂乙醇液不与水混溶同样是不溶解于水的试剂,与吐温或乙醇混溶后慢慢加入水中,有的可完全溶 2020-05-13 …
实验室使用过氧化氢溶液与二氧化锰制取氧气并回收二氧化锰,可供选择的实验仪器和用品如图.(1)制取氧 2020-05-13 …
硝酸钾是实验室常见的化学药品,请回答有关硝酸钾的问题:(1)硝酸钾溶液与其它溶液相同,都具有稳定性 2020-07-29 …
锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaS 2020-12-07 …
在研究酸和碱的化学性质时,某小组同学想证明:HCl与NaOH溶液混合后,虽然仍为无色溶液,但的确发生 2021-01-22 …
下列关于SO2性质的说法中,不正确的是()A.能与NaOH溶液反应B.能使品红溶液褪色C.能与水反应 2021-02-01 …
下列说法正确的是()A.工业合成氨与实验室制取氨气均属于人工固氮B.Al(OH)3和Al2O3分别与 2021-02-01 …
现有30℃的不饱和KNO3溶液,与该溶液有关的量有:(1)水的质量(2)溶液中溶质KNO3的质量(3 2021-02-11 …