早教吧作业答案频道 -->化学-->
利用含铜、铁的粗锌制备硫酸锌及相关物质.工艺流程图及有关数据如下:物质Cu(OH)2Zn(OH)2Fe(OH)3ZnSCuSKsp5.0×10-202.0×10-164.0×10-161.2×10-23
题目详情
利用含铜、铁的粗锌制备硫酸锌及相关物质.工艺流程图及有关数据如下:
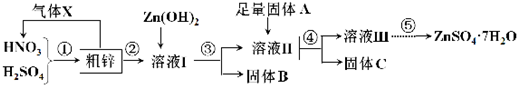
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为___,图中处理气体X要能够体现绿色化学思想,还需补充气体___(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>___mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为___g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为___.
(4)溶液Ⅲ经过蒸发浓缩、___、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是___(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH
+Zn=2NH3+H2↑+Zn2+,造成电量自动减少.写出铅蓄电池不使用时,其正极上发生自放电的化学方程式.___.

| 物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
| Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-16 | 1.2×10-23 | 8.5×10-45 |
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为___,图中处理气体X要能够体现绿色化学思想,还需补充气体___(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>___mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为___g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为___.
(4)溶液Ⅲ经过蒸发浓缩、___、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是___(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH
| + 4 |
▼优质解答
答案和解析
(1)粗锌中的铜与混酸的稀溶液反应,铜被氧化成+2价的铜离子,硝酸被还原成+2价的一氧化氮,反应为:3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O,气体X为一氧化氮,补充氧气在溶液中可发生4NO+O2+2H2O=4HNO3,全部转化成硝酸循环使用,能够体现绿色化学思想,
故答案为:3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O;O2;
(2)固体B为氢氧化铜沉淀,固体C含氢氧化铁沉淀,若溶液I中c(Cu2+)为0.05mol•L-1,根据C(Cu2+)×C2(OH-)>Ksp(Cu(OH)2),C2(OH-)=
,C(OH-)=1×10-9mol/L,需得到固体氢氧化铁根据C(Fe3+)×C3(OH-)>Ksp(Fe(OH)3),C(Fe3+)>
=4×10-11mol/L,
故答案为:4×10-11;
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,而最终为氢氧化物,故沉淀质量为金属质量加上金属阳离子结合氢氧根质量,氢氧根物质的量与金属失电子物质的量相等,而电子与硝酸根结合生成NO,故有氢氧根物质的量为
×3=0.3mol,所以总质量为9.61g+0.3mol×17g/mol=14.71g,若固体A是另一种物质,取部分固体C于试管中,加入足量的盐酸,有臭鸡蛋气味的气体产生,气体为硫化氢,该实验为制备硫酸锌,所以阳离子为锌,阴离子为硫,和盐酸反应生成硫化氢的物质为硫化锌,反应为:ZnS+2H+=H2S↑+Zn2+,
故答案为:14.71;ZnS+2H+=H2S↑+Zn2+;
(4)溶液Ⅲ为硫酸锌溶液,制备七水合硫酸锌,防止结晶水失水,需冷却结晶,溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液,铵根离子水解抑制锌离子水解,因氢氧化锌的Ksp小于硫化锌,用Na2S溶液作为反应物,制得的ZnS含有较多的杂质Zn(OH)2,
故答案为:冷却结晶;Zn(OH)2;
(5)铅蓄电池放电时,Pb作负极、PbO2作正极,负极上Pb失电子而SO42-反应生成PbSO4,反应式为Pb+SO42--2e-=PbSO4,正极上PbO2得电子和SO42-、H+反应生成PbSO4和H2O,正极反应式为:2PbO2+2H2SO4=2PbSO4+2H2O+O2↑,铅蓄电池不使用时,正极PbO2与硫酸发生还原反应,Pb(+4→+2),O(-2→0),发生氧化还原反应:2PbO2+2H2SO4=2PbSO4+2H2O+O2↑,
故答案为:2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.
故答案为:3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O;O2;
(2)固体B为氢氧化铜沉淀,固体C含氢氧化铁沉淀,若溶液I中c(Cu2+)为0.05mol•L-1,根据C(Cu2+)×C2(OH-)>Ksp(Cu(OH)2),C2(OH-)=
| 5×10-20 |
| 5×10-2 |
| 4×10-16 |
| (1×10-9)3 |
故答案为:4×10-11;
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,而最终为氢氧化物,故沉淀质量为金属质量加上金属阳离子结合氢氧根质量,氢氧根物质的量与金属失电子物质的量相等,而电子与硝酸根结合生成NO,故有氢氧根物质的量为
| 2.24L |
| 22.4L/mol |
故答案为:14.71;ZnS+2H+=H2S↑+Zn2+;
(4)溶液Ⅲ为硫酸锌溶液,制备七水合硫酸锌,防止结晶水失水,需冷却结晶,溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液,铵根离子水解抑制锌离子水解,因氢氧化锌的Ksp小于硫化锌,用Na2S溶液作为反应物,制得的ZnS含有较多的杂质Zn(OH)2,
故答案为:冷却结晶;Zn(OH)2;
(5)铅蓄电池放电时,Pb作负极、PbO2作正极,负极上Pb失电子而SO42-反应生成PbSO4,反应式为Pb+SO42--2e-=PbSO4,正极上PbO2得电子和SO42-、H+反应生成PbSO4和H2O,正极反应式为:2PbO2+2H2SO4=2PbSO4+2H2O+O2↑,铅蓄电池不使用时,正极PbO2与硫酸发生还原反应,Pb(+4→+2),O(-2→0),发生氧化还原反应:2PbO2+2H2SO4=2PbSO4+2H2O+O2↑,
故答案为:2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.
看了 利用含铜、铁的粗锌制备硫酸锌...的网友还看了以下:
阅读埃及相关的图文资料,回答下列问题.材料1:埃及地处亚欧非三洲的交通要道.国土95%为沙漠,尼罗 2020-05-15 …
关于x的二次方程7x^2-(a+13)x+2a+2=0有两个实数根分别介于0与1之间以及1与2之间 2020-05-16 …
(1/2)(1)关于x的一元二次方程mx平方-(3m-1)x+2m-1=0的根的判别式值为1,求m 2020-05-16 …
读“美国和巴西大豆产区图”及相关资料,回答1—3题。1、关于两国大豆产区及生产条件的叙述,正确的是 2020-05-17 …
初三物理选择,急!1关于能量及能量之间的转化,下列说法正确的是,A火山具有内能,冰山不具有内能B初 2020-05-20 …
病史问诊主诉:发热2天,咳嗽、咳痰1天。围绕以上简要病史,请将如何询问该患者现病史及相关的内容。( 2020-06-22 …
完成下列活动,列出完成每一项动作所涉及的关节的类型.完成下列活动,列出完成每一项动作所涉及的关节的 2020-07-04 …
阅读埃及相关的图文资料,回答下列问题.材料1:埃及地处亚欧非三洲的交通要道.国土95%为沙漠,尼罗 2020-07-24 …
阅读埃及相关的图文资料,回答下列问题.材料1:埃及地处亚欧非三洲的交通要道.国土95%为沙漠,尼罗 2020-07-24 …
这是一部关于105个好汉和三位女子的故事,请写出这部经典小说的书名以及其中一位女性的姓名及情节。(1 2020-11-04 …