早教吧作业答案频道 -->化学-->
根据下列叙述写出相应的热化学方程式:(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:.(2)如图1是298K、101kPa时,N2与H2反应过程中能量变化的曲
题目详情
根据下列叙述写出相应的热化学方程式:
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:___.
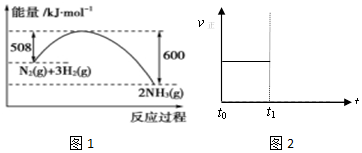
(2)如图1是298K、101kPa时,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式___.
(3)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:
C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.3kJ•mol-1
①若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1molH2O(g)和足量C(s),H2O(g)的平衡转化率为___
②对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___.
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
③上述反应达到平衡后,移走体系中部分C(s),平衡___,将产生的CO全部移走,平衡___(以上两空选填“向左移”、“向右移”、“不移动”).
④上述反应在t0时刻达到平衡(如图2),若在t1时刻改变某一条件,请在图2中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①增大容器体积(用实线表示) ②升高温度(用虚线表示)

(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:___.
(2)如图1是298K、101kPa时,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式___.
(3)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:
C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.3kJ•mol-1
①若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1molH2O(g)和足量C(s),H2O(g)的平衡转化率为___
②对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___.
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
③上述反应达到平衡后,移走体系中部分C(s),平衡___,将产生的CO全部移走,平衡___(以上两空选填“向左移”、“向右移”、“不移动”).
④上述反应在t0时刻达到平衡(如图2),若在t1时刻改变某一条件,请在图2中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①增大容器体积(用实线表示) ②升高温度(用虚线表示)
▼优质解答
答案和解析
(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1.
(3)①C (s)+H2O(g)⇌CO (g)+H2 (g)的平衡常数K=
; 向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),设H2O(g)的变化量为xmol,则
C (s)+H2O(g)⇌CO (g)+H2 (g)
起始物质的量(mol) 1 0 0
变化物质的量(mol) x x x
起始物质的量(mol) 1-x x x
K=c(CO)•c(H2)/c(H2O)=x•x/(1-x)=0.5,解得x=0.5,则H2O(g)的转化率为
=50%,
故答案为:50%;
②a.升高温度反应速率增大且平衡正向移动,可以提高平衡体系中H2的百分含量,故a正确;
b.增大水蒸气的浓度,反应速率增大,生成H2的量增大,但可以平衡体系中H2的百分含量降低,故b错误;
c.加入催化剂反应速率增大,平衡不移动,故c错误;
d.降低压强,平衡正向移动,可以提高平衡体系中H2的百分含量,但反应速率降低,故d错误;故答案为:a;
③改变碳的量,不影响反应速率,不影响平衡的移动;将产生的CO全部移走,平衡右移.
故答案为:不移动;向右移;
④①增大容器体积,浓度减小,正反应速率立即减小;而增大容器体积后平衡右移,反应物浓度继续减小,故正反应速率在立即减小后会继续逐渐减小,故图象为: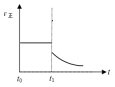 ,故答案为:
,故答案为: ;
;
②升高温度,反应速率加快;而升高温度后平衡右移,反应物浓度继续减小,故正反应速率在立即增大后会逐渐减小,故图象为: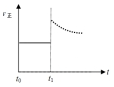 ,故答案为:
,故答案为: .
.
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1.
(3)①C (s)+H2O(g)⇌CO (g)+H2 (g)的平衡常数K=
| c(CO)•c(H2) |
| c(H2O) |
C (s)+H2O(g)⇌CO (g)+H2 (g)
起始物质的量(mol) 1 0 0
变化物质的量(mol) x x x
起始物质的量(mol) 1-x x x
K=c(CO)•c(H2)/c(H2O)=x•x/(1-x)=0.5,解得x=0.5,则H2O(g)的转化率为
| 0.5mol |
| 1mol |
故答案为:50%;
②a.升高温度反应速率增大且平衡正向移动,可以提高平衡体系中H2的百分含量,故a正确;
b.增大水蒸气的浓度,反应速率增大,生成H2的量增大,但可以平衡体系中H2的百分含量降低,故b错误;
c.加入催化剂反应速率增大,平衡不移动,故c错误;
d.降低压强,平衡正向移动,可以提高平衡体系中H2的百分含量,但反应速率降低,故d错误;故答案为:a;
③改变碳的量,不影响反应速率,不影响平衡的移动;将产生的CO全部移走,平衡右移.
故答案为:不移动;向右移;
④①增大容器体积,浓度减小,正反应速率立即减小;而增大容器体积后平衡右移,反应物浓度继续减小,故正反应速率在立即减小后会继续逐渐减小,故图象为:
 ,故答案为:
,故答案为: ;
;②升高温度,反应速率加快;而升高温度后平衡右移,反应物浓度继续减小,故正反应速率在立即增大后会逐渐减小,故图象为:
 ,故答案为:
,故答案为: .
.
看了 根据下列叙述写出相应的热化学...的网友还看了以下:
在质量分数为百分之二十的氯化钠溶液中加如4克氯化钠和16克水,溶解后所得溶液中溶质质量分数为? 2020-04-09 …
某中学为学生供应开水,用锅炉将200kg的水从25℃加热到l00℃,燃烧了6kg的无烟煤,试求:[ 2020-06-12 …
平衡热度断热容器中同时放入50摄氏度的水200g和-15摄氏度冰100g.水的比热为4.2J/gk 2020-06-12 …
1、把500g的水加热到80摄氏度,他吸收了4.2*10^3J的热量,问水原来的温度是?(水的比热 2020-07-02 …
水在热电厂的锅炉中变为水蒸气,通过涡轮机带动发电机发电,用过的水蒸气在液化器中凝结成水,再到锅炉, 2020-07-03 …
用太阳灶给200kg的水加热水温从20℃升高到60℃如果这些热量在没有热量损失的情已知水的比热为4 2020-07-10 …
怎样计算混合物(液体)的比热容(各种液体的比热容已知)如:酒精(2.44*1000焦/千克)与水(4 2020-11-29 …
混合物的比热怎么算?比如:浸了水的沙子.已知沙子的比热是0.924*1000,水的比热是4.2*10 2020-11-29 …
水的体积随温度变化的图象如图所示,若要利用水的流动传热,快速把0℃的水加热到4℃,热源的温度也是4℃ 2020-12-18 …
把一块质量为4千克的铁块烧红,放入冷水中一段时间后,经测量,铁块放热后温度下降了750℃,水吸热后温 2021-02-02 …