早教吧作业答案频道 -->化学-->
二甲醚代替柴油具有绝对的优势.二甲醚制备方法有甲醇液相脱水法和合成气气相制备法两种.回答下列问题:(1)甲醇液相脱水法是将CH3OH与浓硫酸反应生成CH3HS04,该物质再与CH3OH合成CH3
题目详情
二甲醚代替柴油具有绝对的优势.二甲醚制备方法有甲醇液相脱水法和合成气气相制备法两种.回答下列问题:
(1)甲醇液相脱水法是将CH3OH与浓硫酸反应生成CH3HS04,该物质再与CH3OH合成 CH3OCH3.写出上述过程中的化学方程式:___、___.
(2)已知:
甲醇合成反应:CO(g)+2H2(g)═CH3OH(g)△H1=90.7kJ•moL-1
合成二甲醚的反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•moL-1
煤气变换反应:CO(g)+H20(g)═C02(g)+H2(g)△H3=-41.2kJ•moL-1
则:CO与H2直接合成二甲醚的反应:
3CO(g)+3H2(g)═CH3OCH3(g)+C02(g)△H=___
与甲醇液相脱水法相比,CO与H2直接合成二甲醚的优点是___.
(3)如图甲是在容积为1L的容器中通入2molCO和2molH2,发生CO与H2直接合成二甲醚的反应时,CO的平衡转化率随温度、压强的变化关系.
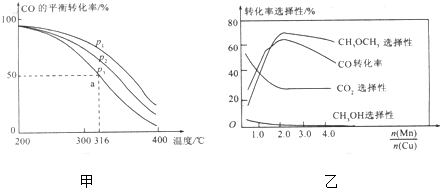
①压强pl、p2、p3的大小关系是___
②316°C时,反应的平衡常数K=___
③若压强为p3,温度为316°C,起始时
=2,则反应达到平衡时,CO的转化率___50%(填”>”、“<”或“=”).
(4)C0与H2直接合成二甲醚法中,若以Cu-Mn比例与反应转化率选择性的关系如图乙,所示.分析图象信息可知最有利于二甲醚合成的
约为___
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池 (5.93kW•h•kg-1).若电解质为酸性,二甲醚直接燃料电池的负极反应为___.
(1)甲醇液相脱水法是将CH3OH与浓硫酸反应生成CH3HS04,该物质再与CH3OH合成 CH3OCH3.写出上述过程中的化学方程式:___、___.
(2)已知:
甲醇合成反应:CO(g)+2H2(g)═CH3OH(g)△H1=90.7kJ•moL-1
合成二甲醚的反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•moL-1
煤气变换反应:CO(g)+H20(g)═C02(g)+H2(g)△H3=-41.2kJ•moL-1
则:CO与H2直接合成二甲醚的反应:
3CO(g)+3H2(g)═CH3OCH3(g)+C02(g)△H=___
与甲醇液相脱水法相比,CO与H2直接合成二甲醚的优点是___.
(3)如图甲是在容积为1L的容器中通入2molCO和2molH2,发生CO与H2直接合成二甲醚的反应时,CO的平衡转化率随温度、压强的变化关系.

①压强pl、p2、p3的大小关系是___
②316°C时,反应的平衡常数K=___
③若压强为p3,温度为316°C,起始时
| n(H2) |
| n(CO) |
(4)C0与H2直接合成二甲醚法中,若以Cu-Mn比例与反应转化率选择性的关系如图乙,所示.分析图象信息可知最有利于二甲醚合成的
| n(Mn) |
| n(Cu) |
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池 (5.93kW•h•kg-1).若电解质为酸性,二甲醚直接燃料电池的负极反应为___.
▼优质解答
答案和解析
(1)CH3OH与浓硫酸反应生成CH3HS04,化学方程式为CH3OH+H2SO4=CH3HS04+H2O,CH3HS04再与CH3OH发生反应生成 CH3OCH3,化学方程式为CH3HS04+CH3OH→CH3OCH3+H2SO4,
故答案为:CH3OH+H2SO4=CH3HS04+H2O、CH3HS04+CH3OH→CH3OCH3+H2SO4;
(2)已知:甲醇合成反应:①CO(g)+2H2(g)═CH3OH(g)△H1=-90.7kJ•moL-1
合成二甲醚的反应:②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•moL-1
煤气变换反应:③CO(g)+H20(g)═C02(g)+H2(g)△H3=-41.2kJ•moL-1,
根据盖斯定律①×2+②+③计算可得CO与H2直接合成二甲醚的反应:3CO(g)+3H2 (g)═CH3OCH3(g)+C02 (g)△H=(=-90.7×2-23.5-41.2)kJ/mol=-246.1kJ/mol;乙烯直接水化法中反应物中气相直接水合法不用硫酸作催化剂,所以不存在硫酸腐蚀设备的问题,
故答案为:-246.1kJ/mol;不存在硫酸腐蚀设备的问题;
(3)①该反应正方向为体积减小的方向,增大压强CO的转化率增大,所以P1>P2>P3,
故答案为:P1>P2>P3;
②在P3和316℃时,CO转化率为50%,根据方程式3CO(g)+3H2 (g)═CH3OCH3(g)+C02可知,平衡时CO的物质的量的浓度为1mol/L,H2的物质的量的浓度为1mol/L,C02的物质的量的浓度为
mol/L,CH3OCH3的物质的量的浓度为
mol/L,所以平衡常数K=
=
,
故答案为:
;
③若在P3和316℃时,起始时
=2>1,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,
故答案为:>;
(4)由图可知当催化剂中
约为2时,CO的转化率最大,生成二甲醚的最多;
故答案为:2;
(5)酸性条件下,二甲醚在负极失电子生成二氧化碳,其电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
故答案为:CH3OCH3-12e-+3H2O=2CO2↑+12H+.
故答案为:CH3OH+H2SO4=CH3HS04+H2O、CH3HS04+CH3OH→CH3OCH3+H2SO4;
(2)已知:甲醇合成反应:①CO(g)+2H2(g)═CH3OH(g)△H1=-90.7kJ•moL-1
合成二甲醚的反应:②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-23.5kJ•moL-1
煤气变换反应:③CO(g)+H20(g)═C02(g)+H2(g)△H3=-41.2kJ•moL-1,
根据盖斯定律①×2+②+③计算可得CO与H2直接合成二甲醚的反应:3CO(g)+3H2 (g)═CH3OCH3(g)+C02 (g)△H=(=-90.7×2-23.5-41.2)kJ/mol=-246.1kJ/mol;乙烯直接水化法中反应物中气相直接水合法不用硫酸作催化剂,所以不存在硫酸腐蚀设备的问题,
故答案为:-246.1kJ/mol;不存在硫酸腐蚀设备的问题;
(3)①该反应正方向为体积减小的方向,增大压强CO的转化率增大,所以P1>P2>P3,
故答案为:P1>P2>P3;
②在P3和316℃时,CO转化率为50%,根据方程式3CO(g)+3H2 (g)═CH3OCH3(g)+C02可知,平衡时CO的物质的量的浓度为1mol/L,H2的物质的量的浓度为1mol/L,C02的物质的量的浓度为
| 1 |
| 3 |
| 1 |
| 3 |
| ||||
| 1×1 |
| 1 |
| 9 |
故答案为:
| 1 |
| 9 |
③若在P3和316℃时,起始时
| n(H 2) |
| n(CO) |
故答案为:>;
(4)由图可知当催化剂中
| n(Mn) |
| n(Cu) |
故答案为:2;
(5)酸性条件下,二甲醚在负极失电子生成二氧化碳,其电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
故答案为:CH3OCH3-12e-+3H2O=2CO2↑+12H+.
看了 二甲醚代替柴油具有绝对的优势...的网友还看了以下:
(2014•贵州模拟)下列关于细胞代谢的叙述,正确的是()A.无氧呼吸过程中生成的[H],[H]用 2020-05-14 …
1mol氢气与1/2mol氧气反应生成1mol水蒸气△H为a,生成1mol液态水△H为b,那么a, 2020-05-17 …
水电里出的H+和OH-不是很少吗?物质在水中与H+或OH-发生水解生成物不会更少吗物质与水电离的H 2020-05-24 …
一水池的容积是100m³,现已蓄水90m³并以5m³/h的速度排水,则水池蓄水量V关于排水一水池的 2020-06-11 …
向正在进行有氧呼吸的细胞悬液中分别加入a、b、c、d四种抑制剂,下列说法正确的是()A.若a能抑制 2020-07-08 …
将1mL0.1mol•L-1的H2SO4溶液加入纯水中制成200mL溶液,该溶液中由水自身电离产生 2020-07-14 …
关于抽水速率与时间的问题问题:顶角为α的正圆锥形漏斗,开始时水深为h.,先往外抽水,已知水面下降速 2020-08-02 …
如图所示压强计的橡皮盒位于水面下H深度,此时U型管中的左右两管水面高度差为h,则有关H与h的大小比较 2020-11-01 …
关于单体脱水缩合形成多聚体的过程中说法错误的是()A.氨基与五碳糖可以为形成水提供H元素B.羧基与磷 2020-11-02 …
六位同学设计了下列几组实验:(1)①②③④⑤实验中能达到目的有(填番号).①实验室制取干燥、纯净的C 2020-11-05 …