早教吧作业答案频道 -->化学-->
工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4.即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如
题目详情
工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4.即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如下:
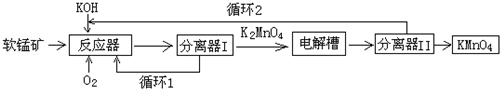
(1)反应器中反应的化学方程式为___.
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量___ (填“偏高”或“偏低”).
(3)电解槽中总的离子反应方程式为___.
(4)在传统工艺中得到K2MnO4后,向其中通入适量CO2反应生成黑色固体、KMnO4等,反应的化学反应方程式为___.
上述反应中氧化剂与还原剂的质量比为___.与该传统工艺相比,电解法的优势是___.
(5)用高锰酸钾测定草酸结晶水合物的纯度:称草酸晶体样品0.500g溶于水配制成100ml溶液,取出20.00ml用0.0200mol•L-1的酸性KMnO4溶液滴定(杂质不反应),至溶液呈浅粉红色且半分钟内不褪去,消耗KMnO4溶液14.80mL,则该草酸晶体的纯度为___.(结果保留3位有效数字)(已知该草酸结晶水合物H2C2O4•2H2O的相对分子质量为126)2422424244

22
2424
-1442242

(1)反应器中反应的化学方程式为___.
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量___ (填“偏高”或“偏低”).
(3)电解槽中总的离子反应方程式为___.
(4)在传统工艺中得到K2MnO4后,向其中通入适量CO2反应生成黑色固体、KMnO4等,反应的化学反应方程式为___.
上述反应中氧化剂与还原剂的质量比为___.与该传统工艺相比,电解法的优势是___.
(5)用高锰酸钾测定草酸结晶水合物的纯度:称草酸晶体样品0.500g溶于水配制成100ml溶液,取出20.00ml用0.0200mol•L-1的酸性KMnO4溶液滴定(杂质不反应),至溶液呈浅粉红色且半分钟内不褪去,消耗KMnO4溶液14.80mL,则该草酸晶体的纯度为___.(结果保留3位有效数字)(已知该草酸结晶水合物H2C2O4•2H2O的相对分子质量为126)2422424244

22
2424
-1442242
▼优质解答
答案和解析
(1)二氧化锰和氢氧化钾、氧气发生反应,生成锰酸钾和水,Mn(+4→+6),O(0→-2),反应的化学方程式为4KOH+2MnO22+O22=2K22MnO44+2H22O,
故答案为:4KOH+2MnO22+O22=2K22MnO44+2H22O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,氧化铝和强碱反应生成偏铝酸盐和水,反应的化学方程式为2KOH+Al22O33=2KAlO22+H22O,所以会导致KOH消耗量偏高,
故答案为:偏高;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H22O+2e--=H22↑+2OH--,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO442-2--2e--=2MnO44--,即MnO442-2--e--=MnO44--,则电极总反应为:2MnO442-2-+2H22O
2MnO4-+2OH-+H2↑,
故答案为:2MnO42-+2H2O
2MnO4-+2OH-+H2↑;
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;
由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO4,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:
×100%=93.2%,
故答案为:93.2%.
电解 电解 电解 电解 2MnO44--+2OH--+H22↑,
故答案为:2MnO442-2-+2H22O
2MnO4-+2OH-+H2↑;
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;
由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO4,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:
×100%=93.2%,
故答案为:93.2%.
电解 电解 电解 电解 2MnO44--+2OH--+H22↑;
(4)反应物为K22MnO44、CO22、生成黑色固体MnO22、KMnO44,所以的化学方程式为:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33;
由化学反应方程式:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33分析得出,3molK22MnO44参加反应生成2molKMnO44、1molMnO22,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO44,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H22C22O44+2MnO44--+6H++=10CO22↑+2Mn2+2++8H22O,根据方程式可得关系式:
5H22C22O44•2H22O~2KMnO44
5 2
n 0.02mol/L×14.8×10-3-3L×
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:
×100%=93.2%,
故答案为:93.2%.
100mL 20mL 100mL 100mL 100mL20mL 20mL 20mL
解得:n(H22C22O44•2H22O)=3.7×10-3-3mol
则m(H22C22O44•2H22O)=3.7×10-3-3mol×126g/mol=0.4662g,
所以成品的纯度为:
×100%=93.2%,
故答案为:93.2%.
0.4662g 0.500g 0.4662g 0.4662g 0.4662g0.500g 0.500g 0.500g×100%=93.2%,
故答案为:93.2%.
故答案为:4KOH+2MnO22+O22=2K22MnO44+2H22O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,氧化铝和强碱反应生成偏铝酸盐和水,反应的化学方程式为2KOH+Al22O33=2KAlO22+H22O,所以会导致KOH消耗量偏高,
故答案为:偏高;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H22O+2e--=H22↑+2OH--,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO442-2--2e--=2MnO44--,即MnO442-2--e--=MnO44--,则电极总反应为:2MnO442-2-+2H22O
| ||
故答案为:2MnO42-+2H2O
| ||
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;
由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO4,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×
| 100mL |
| 20mL |
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:
| 0.4662g |
| 0.500g |
故答案为:93.2%.
| ||
| 电解 |
. |
| 电解 |
. |
| 电解 |
. |
| 电解 |
. |
.
.
.
.
.故答案为:2MnO442-2-+2H22O
| ||
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;
由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO4,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×
| 100mL |
| 20mL |
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:
| 0.4662g |
| 0.500g |
故答案为:93.2%.
| ||
| 电解 |
. |
| 电解 |
. |
| 电解 |
. |
| 电解 |
. |
.
.
.
.
.(4)反应物为K22MnO44、CO22、生成黑色固体MnO22、KMnO44,所以的化学方程式为:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33;
由化学反应方程式:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33分析得出,3molK22MnO44参加反应生成2molKMnO44、1molMnO22,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO44,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H22C22O44+2MnO44--+6H++=10CO22↑+2Mn2+2++8H22O,根据方程式可得关系式:
5H22C22O44•2H22O~2KMnO44
5 2
n 0.02mol/L×14.8×10-3-3L×
| 100mL |
| 20mL |
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:
| 0.4662g |
| 0.500g |
故答案为:93.2%.
| 100mL |
| 20mL |
解得:n(H22C22O44•2H22O)=3.7×10-3-3mol
则m(H22C22O44•2H22O)=3.7×10-3-3mol×126g/mol=0.4662g,
所以成品的纯度为:
| 0.4662g |
| 0.500g |
故答案为:93.2%.
| 0.4662g |
| 0.500g |
故答案为:93.2%.
看了 工业上以软锰矿(主要成分Mn...的网友还看了以下:
怎么性生活男女怎么过性生活 2021-03-30 …
怎样过性生活性生活不好怎么办 2021-03-30 …
如何过性生活性生活时间短吃什么药 2021-03-30 …
女人怀孕能不能过性生活怀孕多长时间能过性生活 2021-03-30 …
怀孕能性生活吗怀孕能过性生活吗 2021-03-30 …
关于性生活怀孕可以过性生活吗 2021-03-30 …
50女人性生活怀孕能过性生活吗 2021-03-31 …
怀孕能过性生活吗女人怀孕能不能过性生活 2021-04-04 …
怎么过性生活一个人怎么过性生活 2021-04-04 …
过性生活的好处男人过性生活的好处 2021-04-05 …