早教吧作业答案频道 -->化学-->
(Ⅰ)部分弱酸的电离平衡常数如表:弱酸HCOOHHClOH2CO3H2SO3电离平衡常数(25℃)Ka=1.77×10-4Ka=4.0×10-8Ka1=4.3×10-7Ka2=4.7×10-11Ka1=1.54×10-2Ka2=1.02×10
题目详情
(Ⅰ)部分弱酸的电离平衡常数如表:
(1)室温下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的关系为___.
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式___.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为___.
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.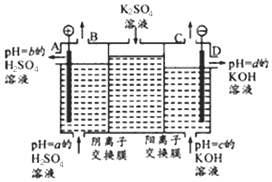
①该电解槽中通过阴离子交换膜的离子数___(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为___;
③电解一段时间后,B出口与C出口产生气体的质量比为___.
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式___.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为___.
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.

①该电解槽中通过阴离子交换膜的离子数___(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为___;
③电解一段时间后,B出口与C出口产生气体的质量比为___.
▼优质解答
答案和解析
(Ⅰ)(1)图表中比较得到酸性强弱H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,对应盐水解程度HSO3--32-3--32-,室温下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的关系为:③②④①,
故答案为:③②④①;
(2)水解程度越大,溶液中酸根离子浓度越小,水解程度:CO32->SO32-,则溶液中离子浓度:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(3)根据强酸制取弱酸知,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,少量CO2通入到过量的NaClO溶液中生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(4)甲酸为弱电解质,pH=3的甲酸和pH=11的氢氧化钠溶液等体积混合,甲酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(HCOO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)-),离子浓度顺序是:c(HCOO-)>c(Na+)>c(H+)>c(OH-).
故答案为:c(HCOO-)>c(Na+)>c(H+)>c(OH-);
(Ⅱ)①电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知钾离子数目大于硫酸根离子数目,
故答案为:<;
②阳极上阴离子OH-被氧化,pH减小,阴极阳离子氢离子发生还原反应生成H2和OH-,pH增大,则pH为b③B口生成氧气,C生成氢气,物质的量之比为1:2,则质量之比为32:4=8:1,
故答案为:8:1.
故答案为:③②④①;
(2)水解程度越大,溶液中酸根离子浓度越小,水解程度:CO32->SO32-,则溶液中离子浓度:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(3)根据强酸制取弱酸知,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,少量CO2通入到过量的NaClO溶液中生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(4)甲酸为弱电解质,pH=3的甲酸和pH=11的氢氧化钠溶液等体积混合,甲酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(HCOO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)
故答案为:c(HCOO-)>c(Na+)>c(H+)>c(OH-);
(Ⅱ)①电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知钾离子数目大于硫酸根离子数目,
故答案为:<;
②阳极上阴离子OH-被氧化,pH减小,阴极阳离子氢离子发生还原反应生成H2和OH-,pH增大,则pH为b
故答案为:8:1.
看了 (Ⅰ)部分弱酸的电离平衡常数...的网友还看了以下:
将等物质的量的MG和AL混合均匀,取等质量的该混合物4份,分别加入到足量的下列溶液中,充分反应后, 2020-05-16 …
1.2 mol/L的盐酸溶液200L和4 mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的 2020-05-16 …
将以下4份溶液分别置于如图的装置中,其它条件相同时,灯泡最亮的是()A.100mL1mol/L的盐 2020-06-19 …
6mol/L的盐酸和1mol/L的盐酸B混合,配成2mol/L的盐酸时,A和B的体积比为(假设混合 2020-06-27 …
这个通达信指标是什么意思内外盘差}PJ:=(H+L+C)/3;V1:=IF(H=L,1,H-MAX 2020-07-09 …
(2009•肇庆一模)某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差 2020-07-15 …
9.2mol/l高氯酸的配制方法做实验急求9.2mol/l高氯酸和4.6mol/l高氯酸的配制方法 2020-07-21 …
4体内胃酸的主要成分是盐酸,胃酸过o,可引起一系列胃病,某胃药的标签中部分内容如a药品胃酸抑制剂主要 2020-11-03 …
常温下有下列四种溶液:①②③④溶液pH=4的NH4ClpH=4的盐酸0.1mol•L-1的醋酸0.1 2021-02-01 …
常温下有下列四种溶液:①②③④溶液pH=4的NH4ClpH=4的盐酸0.1mol•L-1的醋酸0.1 2021-02-01 …