早教吧作业答案频道 -->化学-->
氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.(1)已知:Mg(s)+H2(g)═MgH2(s)△H=-74.5kJ.mol-1Mg2Ni
题目详情
氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.
(1)已知:
Mg(s)+H2(g)═MgH2(s)△H=-74.5kJ.mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H=-64.4kJ•mol-1
则Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H=___kJ.mol-1
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2═MgH2+2Al+3H2↑.反应中每转移3mol电子时,产生的H2在标准状况下的体积为___L.
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g)⇌LaNi5H6(s)△H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是___(填字母编号).
a.增加LaNi5H6(s)的量 b.升高温度 c.减小压强d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)
(g)
 (g)+3H2(g)
(g)+3H2(g)
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol•L-1,平衡时苯的浓度为b mol•L-1,该反应的平衡常数K=___(用含a、b的代数式表示).
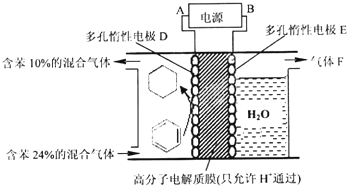
②一定条件下,如图装置可实现有机物的电化学储氢(忽略其它有机物).
A是电源的___极(填“正”或“负”);电解过程中产生的气体F为___(填化学式):电极D上发生的电极反应为___.

(1)已知:
Mg(s)+H2(g)═MgH2(s)△H=-74.5kJ.mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H=-64.4kJ•mol-1
则Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H=___kJ.mol-1
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2═MgH2+2Al+3H2↑.反应中每转移3mol电子时,产生的H2在标准状况下的体积为___L.
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g)⇌LaNi5H6(s)△H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是___(填字母编号).
a.增加LaNi5H6(s)的量 b.升高温度 c.减小压强d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)
(g) | FeSO4/Al2O3 |
| |
| 高温 |
 (g)+3H2(g)
(g)+3H2(g)①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol•L-1,平衡时苯的浓度为b mol•L-1,该反应的平衡常数K=___(用含a、b的代数式表示).
②一定条件下,如图装置可实现有机物的电化学储氢(忽略其它有机物).
A是电源的___极(填“正”或“负”);电解过程中产生的气体F为___(填化学式):电极D上发生的电极反应为___.
▼优质解答
答案和解析
(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H3 =-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6KJ/mol,则△H3=+84.6KJ/mol,
故答案为:+84.6;
(2)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,从方程式可知反应中每转移6mol电子时生成3mol,所以反应中每转移3mol电子时产生的H2的物质的量为1.5,生成氢气33.6L;
故答案为:33.6;
(3)①欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)⇌LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;
故答案为:bc;
(4)①)①环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=
=
mol3•L-3;
故答案为:
mol3•L-3;
该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体F为O2,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:负; O2;C6H6+6H++6e-=C6H12.
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H3 =-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6KJ/mol,则△H3=+84.6KJ/mol,
故答案为:+84.6;
(2)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,从方程式可知反应中每转移6mol电子时生成3mol,所以反应中每转移3mol电子时产生的H2的物质的量为1.5,生成氢气33.6L;
故答案为:33.6;
(3)①欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)⇌LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;
故答案为:bc;
(4)①)①环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=
| C(C6H6)C3(H2) |
| C(C6H12) |
| 27b4 |
| a-b |
故答案为:
| 27b4 |
| a-b |
该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体F为O2,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:负; O2;C6H6+6H++6e-=C6H12.
看了 氢气是一种理想的“绿色能源”...的网友还看了以下:
(生物)用绿豆发豆芽,1KG绿豆长出4KG绿豆芽用绿豆发豆芽,1KG绿豆长出4KG绿豆芽,这过程中 2020-04-25 …
王安石在写诗过程中反复选择用字“绿”而成为千古名句的是? 2020-06-09 …
英语翻译沙垄平缓部分挖土以推土机推土为主;沙丘部分先以挖掘机挖土,再用推土机推平;场内部分土方和外 2020-06-26 …
选择合适的实验材料和试剂是实验成功的关键,下列实验材料或试剂替换后不能达到实验目的是()A.用藓类 2020-06-27 …
一种藤状植物!灰绿色的没有叶子,藤装弯弯曲曲卷在一起,貌似不用土只用喷点水,可以挂在墙上的.店员说 2020-07-02 …
学校绿化节上,六年级10名同学正用14个箩筐运土,已知一名同学挑2个箩筐运土,两名学生抬一个箩筐运 2020-07-06 …
在城市绿化时,经常可以看到移栽一些大树时,首先①沿离树干一定距离的位置挖开土;②用草绳将树的根及包 2020-07-15 …
生态厕所是自身具备良性循环的厕所,一般具有生态建筑的三个特点:一是地下设有沼气净化池;二是屋顶要覆土 2020-11-02 …
选择恰当的语句小河上的薄冰在阳光下融化已尽,小草从暖湿的泥土中苏醒,(),造化的神工又一次使人们惊异 2020-11-04 …
绿色植物里叶绿素是绿色的,用绿色光照射植物对植物生长最有利吗?大神们帮帮忙绿色光照完全不光合作用,叶 2020-12-24 …