早教吧作业答案频道 -->化学-->
根据题意回答问题:(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:①加水稀释10倍后,醋酸溶液中的c(H+)盐酸溶液中的c(H+)(填“>”、“=”或“<”
题目详情
根据题意回答问题:
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)___盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸___盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸___盐酸(填“>”、“=”或“<”).
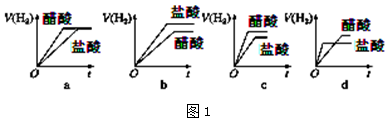
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
___(填字母).
(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.
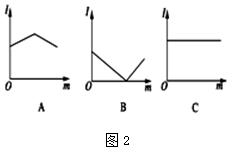
①氢氧化钡溶液中滴入硫酸溶液至过量___.
②醋酸溶液中滴入氨水至过量___.
③澄清石灰水中通入CO2至过量___.
(3)已知表中的电离平衡常数,回答问题
①HSO3-的电离平衡常数表达式为:___.
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为___.
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)___盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸___盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸___盐酸(填“>”、“=”或“<”).
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
___(填字母).

(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.

①氢氧化钡溶液中滴入硫酸溶液至过量___.
②醋酸溶液中滴入氨水至过量___.
③澄清石灰水中通入CO2至过量___.
(3)已知表中的电离平衡常数,回答问题
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为___.
▼优质解答
答案和解析
(1)pH相同、体积相同的醋酸和盐酸两种溶液总氢离子浓度相同,则醋酸溶液中溶质浓度大于盐酸溶液中HCl的浓度,
①pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,醋酸是弱酸存在电离平衡,又电离出氢离子,醋酸溶液中的c(H+)>盐酸溶液中的c(H+),故答案为:>;
②pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积醋酸>盐酸,故答案为:>;
③盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,溶液中c(H+):醋酸>盐酸,故答案为:>;
④因为强酸完全电离,一元弱酸部分电离,因此要有相同的PH值,一元弱酸的浓度必须比强酸高,由于体积相等,因此一元弱酸的物质的量大于强酸,因此产生的H2也比强酸多.反应过程由于H+不断被消耗掉,促使一元弱酸继续电离,这就延缓了H+浓度下降的速率,而强酸没有H+的补充途径,浓度下降的更快,由于其他条件都相同,反应速率取决于H+浓度,由于开始时H+浓度相等,因此反应速率也相等(在图中反应速率就是斜率),后面强酸的反应速率下降得快,斜率也就更小,曲线更平坦.最终生成H2的体积也比一元弱酸少,因此曲线在一元弱酸下面;
故选c,
故答案为:c;
(2)溶液导电能力与离子浓度成正比,与电荷成正比,与电解质强弱无关,
A中溶液导电能力先增大后减小,则A溶液中离子浓度先增大后减小;
B中溶液导电能力先减小后增大,则B溶液中离子浓度先减小后增大;
C中溶液导电能力不变,说明C溶液中离子浓度不变,
①.该反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,随着稀硫酸的加入,离子浓度减小,当二者恰好反应时离子浓度最小,溶液导电能力最小;继续加入稀硫酸时,离子浓度增大,溶液导电能力增大,故答案为:B;
②.离子反应方程式为CH3COOH+NH3.H2O=NH4++CH3COO-,随着一水合氨的加入,离子浓度增大,溶液导电能力增大,二者恰好反应时溶液导电能力最大;继续加入氨水,离子浓度减小,溶液导电能力减小,故答案为:A;
③.离子反应方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,随着二氧化碳的通入,离子浓度减小,溶液导电能力降低,二者恰好反应时离子浓度最小,溶液导电能力最低,继续通入二氧化碳,二者反应生成可溶性强电解质,CaCO3+H2O+CO2=Ca(HCO3)2,离子浓度增大,溶液导电能力增强,故答案为:B;
(3)HSO3-的电离平衡常数表达式为:K=
,故答案为:
;
②由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O.
①pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,醋酸是弱酸存在电离平衡,又电离出氢离子,醋酸溶液中的c(H+)>盐酸溶液中的c(H+),故答案为:>;
②pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积醋酸>盐酸,故答案为:>;
③盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,溶液中c(H+):醋酸>盐酸,故答案为:>;
④因为强酸完全电离,一元弱酸部分电离,因此要有相同的PH值,一元弱酸的浓度必须比强酸高,由于体积相等,因此一元弱酸的物质的量大于强酸,因此产生的H2也比强酸多.反应过程由于H+不断被消耗掉,促使一元弱酸继续电离,这就延缓了H+浓度下降的速率,而强酸没有H+的补充途径,浓度下降的更快,由于其他条件都相同,反应速率取决于H+浓度,由于开始时H+浓度相等,因此反应速率也相等(在图中反应速率就是斜率),后面强酸的反应速率下降得快,斜率也就更小,曲线更平坦.最终生成H2的体积也比一元弱酸少,因此曲线在一元弱酸下面;
故选c,
故答案为:c;
(2)溶液导电能力与离子浓度成正比,与电荷成正比,与电解质强弱无关,
A中溶液导电能力先增大后减小,则A溶液中离子浓度先增大后减小;
B中溶液导电能力先减小后增大,则B溶液中离子浓度先减小后增大;
C中溶液导电能力不变,说明C溶液中离子浓度不变,
①.该反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,随着稀硫酸的加入,离子浓度减小,当二者恰好反应时离子浓度最小,溶液导电能力最小;继续加入稀硫酸时,离子浓度增大,溶液导电能力增大,故答案为:B;
②.离子反应方程式为CH3COOH+NH3.H2O=NH4++CH3COO-,随着一水合氨的加入,离子浓度增大,溶液导电能力增大,二者恰好反应时溶液导电能力最大;继续加入氨水,离子浓度减小,溶液导电能力减小,故答案为:A;
③.离子反应方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,随着二氧化碳的通入,离子浓度减小,溶液导电能力降低,二者恰好反应时离子浓度最小,溶液导电能力最低,继续通入二氧化碳,二者反应生成可溶性强电解质,CaCO3+H2O+CO2=Ca(HCO3)2,离子浓度增大,溶液导电能力增强,故答案为:B;
(3)HSO3-的电离平衡常数表达式为:K=
| c(H+)c(SO32-) |
| c(HSO3-) |
| c(H+)c(SO32-) |
| c(HSO3-) |
②由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O.
看了 根据题意回答问题:(1)常温...的网友还看了以下:
当F浮——G物时,物体上浮,(p物——p液)上浮的最终结果是物体处于漂浮状态,当物体漂浮时,F浮— 2020-05-16 …
浮力的几个公式分别什么时候用?浮力公式好多,字母也多,1.F浮=F向上-F向下2.F向上-F向下= 2020-06-08 …
某温度下,下列溶液肯定呈酸性的是A.含H+的溶液B.加酚酞显无色的溶液C.pH<7的溶液D.c(H 2020-07-15 …
已知一盛有液体的容器中液面上的压力Po=10¬5pa,液面的密度p=997.0kg/m³,试求在液 2020-07-18 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
下列溶液,一定呈中性的是()A.由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液B. 2020-11-02 …
p{font-size:10.5pt;line-height:150%;margin:0;paddi 2020-11-12 …
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒 2020-12-20 …
液体压强的公式为P=ρgh,ρ为液体的密度,h为液体的高度.若液体中浸有其他物体,使液体的高度变高, 2020-12-27 …
3.y=a(x-h+p)+k4.y=a(x-h-f)+k又没有详解?y=a(x-h)+k移动后的解析 2021-02-05 …