早教吧作业答案频道 -->化学-->
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:①配制0.1mol•L-1的HCl溶液和0.1mol•L-1的NaOH溶液各100mL;
题目详情
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
①配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液各100mL;
②取一粒(药片质量均相同)0.2g的此药片,磨碎后放入烧杯中并加入20.0mL蒸馏水;
③以酚酞为指示剂,用0.1 mol•L-1的NaOH溶液滴定,用去V mL达到滴定终点;
④向烧杯中加入25mL 0.1 mol•L-1的HCl溶液.
(1)请写出正确的实验操作顺序(用序号表示):___.
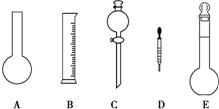
(2)在下图所示的仪器中配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液肯定不需要的是(填序号)___,配制上述溶液还需要的玻璃仪器是(填仪器的名称)___.
(3)配制上述溶液应选用的容量瓶规格是___mL.
(4)写出步骤④中发生的有关反应的离子方程式:___.
(5)在进行步骤③时,判断到达滴定终点时的标志是___.
(6)每粒该胃药中含碳酸钙的质量是___.
①配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液各100mL;
②取一粒(药片质量均相同)0.2g的此药片,磨碎后放入烧杯中并加入20.0mL蒸馏水;
③以酚酞为指示剂,用0.1 mol•L-1的NaOH溶液滴定,用去V mL达到滴定终点;
④向烧杯中加入25mL 0.1 mol•L-1的HCl溶液.

(1)请写出正确的实验操作顺序(用序号表示):___.
(2)在下图所示的仪器中配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液肯定不需要的是(填序号)___,配制上述溶液还需要的玻璃仪器是(填仪器的名称)___.
(3)配制上述溶液应选用的容量瓶规格是___mL.
(4)写出步骤④中发生的有关反应的离子方程式:___.
(5)在进行步骤③时,判断到达滴定终点时的标志是___.
(6)每粒该胃药中含碳酸钙的质量是___.
▼优质解答
答案和解析
(1)用中和滴定法胃药中碳酸钙的含量,先把药片磨碎溶于水,配制0.1 mol•L-1的HCl溶液和0.1 mol•L-1的NaOH溶液,加过量的盐酸溶解碳酸钙,再用氢氧化钠滴定剩余的盐酸,则实验操作顺序为②①④③,
故答案为:②①④③;
(2)配制溶液的主要操作为:称量或量取用到天平或量筒、在烧杯中溶解用到烧饼和玻璃棒、转移到容量瓶用到容量瓶和玻璃棒、定容用到胶头滴管,所以没有用到的仪器是烧瓶和分液漏斗,即AC;除了图中所给的仪器还需要烧杯和玻璃棒;
故答案为:AC;烧杯、玻璃棒;
(3)要配制100ml盐酸和氢氧化钠溶液,所以选用100ml的容量瓶;
故答案为:100;
(4)步骤④中为盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,其反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(5)以酚酞作指示剂,用氢氧化钠滴定盐酸,溶液由无色变为浅红色,则滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色即是滴定终点;
故答案为:滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色;
(6)与氢氧化钠反应的盐酸为n(HCl)=n(NaOH)=0.1 mol•L-1×10-3VL=10-4Vmol;
与碳酸钙反应的盐酸为n′(HCl)=0.1 mol•L-1×0.025L-10-4Vmol=(0.0025-10-4V)mol,
已知碳酸钙与盐酸的反应为:CaCO3+2H+═Ca2++CO2↑+H2O,则n(CaCO3)=
×(0.0025-10-4V)mol,
则每粒该胃药中含碳酸钙的质量是
×(0.0025-10-4V)mol×100g/mol=(0.125-0.005V)g;
故答案为:(0.125-0.005V)g.
故答案为:②①④③;
(2)配制溶液的主要操作为:称量或量取用到天平或量筒、在烧杯中溶解用到烧饼和玻璃棒、转移到容量瓶用到容量瓶和玻璃棒、定容用到胶头滴管,所以没有用到的仪器是烧瓶和分液漏斗,即AC;除了图中所给的仪器还需要烧杯和玻璃棒;
故答案为:AC;烧杯、玻璃棒;
(3)要配制100ml盐酸和氢氧化钠溶液,所以选用100ml的容量瓶;
故答案为:100;
(4)步骤④中为盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,其反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(5)以酚酞作指示剂,用氢氧化钠滴定盐酸,溶液由无色变为浅红色,则滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色即是滴定终点;
故答案为:滴入最后一滴NaOH溶液时,使溶液由无色变为浅红色,且半分钟内不褪色;
(6)与氢氧化钠反应的盐酸为n(HCl)=n(NaOH)=0.1 mol•L-1×10-3VL=10-4Vmol;
与碳酸钙反应的盐酸为n′(HCl)=0.1 mol•L-1×0.025L-10-4Vmol=(0.0025-10-4V)mol,
已知碳酸钙与盐酸的反应为:CaCO3+2H+═Ca2++CO2↑+H2O,则n(CaCO3)=
| 1 |
| 2 |
则每粒该胃药中含碳酸钙的质量是
| 1 |
| 2 |
故答案为:(0.125-0.005V)g.
看了 碳酸钙可以降低胃酸的浓度而被...的网友还看了以下:
如图是实验室所用硫酸试剂瓶上标签的部分内容,请仔细阅读后计算:(1)硫酸的相对分子质量,硫酸中H、 2020-05-13 …
我用的是溶剂型封纯油,其中有石油磺酸钡防锈添加剂,为什么粘手?是磺酸钡的事么 硬膜封存油.为什么粘 2020-05-13 …
英语翻译摘要:本文主要研究以硫酸氢纳为催化剂合成丙烯酸正丁酯.详细探讨了催化剂用量,酸醇投料比,反 2020-06-07 …
近年来,乳酸成为人们的研究热点之一.乳酸作为酸味剂,既能使食品具有微酸性,又不掩盖水果和蔬菜的天然 2020-06-13 …
食品保鲜剂、脱氧剂、脱酸素剂有什么区别?最近我看到超市里的食品中有一些小袋子,开始我以为是干燥剂. 2020-06-20 …
请问镀镍液,主液是:硫酸镍,氯化镍,硫酸钴.添加剂为:硼酸、硫酸镁、糖精,1.4炔丁二醇,十二烷基 2020-06-27 …
草酸又称为乙二酸,化学式为H2C2O4,主要用作还原剂和漂白剂.将硫酸酸化的0.2mol/L的酸性 2020-07-05 …
某种能够提供医用氧气的便携式制氧器,其制氧剂为复方过碳酸钠(含A、B剂).A剂的主要成分为过碳酸钠, 2020-11-07 …
亮氨酸(C6H13NO2)可作为营养增补剂;调味增香剂,可配制氨基酸输液及综合氨基酸制剂,降血糖剂, 2020-12-06 …
已知某硫酸试剂上的标签如下:硫酸的相对分子质量等于98,密度为1.84g/cm³,硫酸的质量分数为9 2021-02-01 …