早教吧作业答案频道 -->化学-->
SnSO4用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上SnSO4的制备
题目详情
SnSO4用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上SnSO4的制备路线如图:
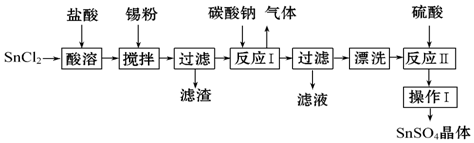
已知:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.
回答下列问题:
(1)锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是___.
(2)操作Ⅰ是___、___、过滤、洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因:___.
(4)加入锡粉的作用有两个:①调节溶液pH,②___.
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是___.
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是___.
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,反应为Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3氧化Sn2+生成Sn4+;
③用已知浓度的盐酸酸化过的K2Cr2O7滴定生成的FeCl2,反应的化学方程是:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
取1.360g锡粉,经上述各步反应后,共用去0.100mol•L-1K2Cr2O7溶液33.00mL,则锡粉中锡的质量分数是___.(保留一位小数)

已知:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.
回答下列问题:
(1)锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是___.
(2)操作Ⅰ是___、___、过滤、洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因:___.
(4)加入锡粉的作用有两个:①调节溶液pH,②___.
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是___.
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是___.
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,反应为Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3氧化Sn2+生成Sn4+;
③用已知浓度的盐酸酸化过的K2Cr2O7滴定生成的FeCl2,反应的化学方程是:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
取1.360g锡粉,经上述各步反应后,共用去0.100mol•L-1K2Cr2O7溶液33.00mL,则锡粉中锡的质量分数是___.(保留一位小数)
▼优质解答
答案和解析
SnCl2粉末加浓盐酸进行溶解得到酸性溶液,此时溶液中含有Sn2+、Sn4+,向其中加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH值,另外Sn可以将被氧化生成的Sn4+还原成Sn2+,即防止Sn2+被氧化为Sn4+,过滤得SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,其原子核外有5个电子层,所以位于第5周期第IVA族,
故答案为:第5周期ⅣA族;
(2)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,所以操作I是蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩;冷却结晶;
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O⇌Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O⇌Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化,
故答案为:防止Sn2+被氧化;
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O.
(7)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~
K2Cr2O7
119g
mol
1.360g×x 0.100mol/L×0.033L
故119g:
mol=(1.360g×x):(0.100mol/L×0.033L)
x=
=86.6%,
故答案为:86.6%.
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,其原子核外有5个电子层,所以位于第5周期第IVA族,
故答案为:第5周期ⅣA族;
(2)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,所以操作I是蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩;冷却结晶;
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O⇌Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O⇌Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化,
故答案为:防止Sn2+被氧化;
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O.
(7)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~
| 1 |
| 3 |
119g
| 1 |
| 3 |
1.360g×x 0.100mol/L×0.033L
故119g:
| 1 |
| 3 |
x=
| 119g×(0.100mol/L×0.033L) | ||
|
故答案为:86.6%.
看了 SnSO4用于合金、马口铁、...的网友还看了以下:
几个英语!1.上一节英语课.2.在周六下午.3.去看音乐会.4.去商业街.5.持续做某事.6.顺便 2020-05-13 …
酸性条件下,锡元素在水溶液中有Sn2+、Sn4+两种主要存在形式.SnSO4是一种重要的硫酸盐,广 2020-07-07 …
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下 2020-07-07 …
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.SnSO4是一种重要的硫酸盐,广泛应 2020-07-07 …
硫酸亚锡(SuSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下 2020-07-07 …
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下 2020-07-07 …
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业.SnSO4的实验室制备设计 2020-07-07 …
烧水壶里面的镀层是什么?我买了个烧水壶,看到里面有两个黑色斑点.才发现水壶里面那层银白色似乎像镀上去 2020-11-11 …
铬是一种银白色的金属,化学性质稳定,常用于金属加工、电镀等行业中.工业上以铬铁矿[主要成分是Fe(C 2020-12-08 …
电镀在工业上有着广泛的应用可以镀锌、镀铜、镀金等。利用如图所示装置可以将铜牌变为银牌即在铜牌表面电镀 2020-12-08 …