近年来大气问题受到人们越来越多的关注.按要求回答下列问题:Ⅰ.实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.
近年来大气问题受到人们越来越多的关注.按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图1.
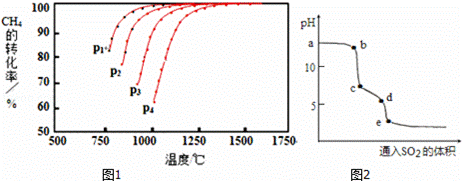
则p1、p2、p3、p4由大到小的顺序 P4>P3>P2>P1 ,该反应的正反应是 吸热 (填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K= 1024 .
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
CH4(g)+2NO2 (g)=N2(g)+CO2(g)+2H2O(g)△H3
则△H3= ﹣867kJ•mol﹣1 ,如果三个反应的平衡常数依次为K1、K2、K3,则K3= 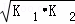 (用K1、K2表示)
(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中的pH变化曲线如图2所示.
①ab段发生反应的离子方程式为 SO2+2OH﹣=SO32﹣+H2O .
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为 c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣) ,如果NaHSO3的水解平衡常数Kh=1×10﹣12mol•L﹣1,则该温度下H2SO3的第一步电离平衡常数Ka= 10﹣2mol•L﹣1 .
考点:
转化率随温度、压强的变化曲线;用盖斯定律进行有关反应热的计算;化学平衡常数的含义;离子浓度大小的比较..
专题:
化学反应中的能量变化;化学平衡专题;电离平衡与溶液的pH专题.
分析:
Ⅰ、由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答; 由图1可知,压强为P4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,据此计算甲烷的浓度变化量,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算该温度下的平衡常数; Ⅱ、(1)依据已知的热化学方程式利用盖斯定律解答; (2)①向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中首先发生SO2+2OH﹣=SO32﹣+H2O,其次发生SO2+SO32﹣+H2O=2HSO3﹣;据此分析; ②d点时溶液中溶质为NaHSO3,HSO3﹣电离大于水解溶液呈酸性;H2SO3的第一步电离平衡常数Ka=,NaHSO3的水解平衡常数Kh=,据此分析.
Ⅰ、由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,由图可知,压强一定时,温度越高甲烷的转化率越大,说明升温平衡向正反应方向移动,所以正反应为吸热反应;由图1可知,当1000℃甲烷的转化率为80%时, CH4(g)+CO2(g)=2CO(g)+2H2(g), 开始(mol/L):2.5 2.5 0 0 变化(mol/L):2.5×80%=2 2 4 4 平衡(mol/L):0.5 0.5 4 4 该温度下平衡常数k==1024; 故答案为:P4>P3>P2>P1;吸热,1024; Ⅱ.(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1 ②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1 由盖斯定律(①+②)÷2得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1,如果三个反应的平衡常数依次为K1、K2、K3,则K3= ,故答案为:﹣867kJ•mol﹣1;; (2)①向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中首先发生SO2+2OH﹣=SO32﹣+H2O,其次发生SO2+SO32﹣+H2O=2HSO3﹣;所以ab段发生反应的离子方程式为SO2+2OH﹣=SO32﹣+H2O,故答案为:SO2+2OH﹣=SO32﹣+H2O; ②d点时溶液中溶质为NaHSO3,HSO3﹣电离大于水解溶液呈酸性,所以溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣);H2SO3的第一步电离平衡常数Ka=,NaHSO3的水解平衡常数Kh=,所以Ka==10﹣2 mol•L﹣1, 故答案为:c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣),10﹣2 mol•L﹣1.
点评:
本题考查反应热的计算、平衡图象及其平衡常数的计算、溶液中的离子浓度的比较等,题目综合性较大,难度中等.
日本是世界她进口木材最多n国家之u,其主要原因是()A.森林资源贫乏,森林覆盖率低B.木材加工业是 2020-05-14 …
杂合子所占比例的计算让杂合子Aa连续自交三代,则第四代中杂合子所占比例为多少?注:要说出是怎么算得 2020-06-16 …
青少年不要染上吸烟的不良嗜好,因为吸烟影响神经系统.主要表现在()A.降低记忆力和注意力,使血管收 2020-07-05 …
字母和数字组成26个英文字母大小写和0-9十个数字组成3位以上和10位以下的全部组成急用!我不怕占 2020-07-23 …
在与异性同学交往中,要注意自己的言行举止,其中对衣着方面的要求是()A.追赶潮流,尽显成熟风范B.整 2020-11-07 …
新疆伊犁河谷植被茂密,空气清新,含氧量高;空气湿度大,降雨量多.主要原因是由于植物的()A.光合作用 2020-12-08 …
修花坛要用94块砖,第一次搬来36块,第二次搬来同样多.还要搬来多少块才够?(用两种方法解答) 2020-12-08 …
如图是利用小鼠制备抵抗埃博拉病毒的单克隆抗体的示意图.请据图回答下列问题:(1)给小鼠多次注射同一抗 2020-12-14 …
有一位同学要试一试注射器出药水的小孔封住时,拉出注射器活塞的力要多大.注射器容积为10毫升,0—10 2020-12-22 …
(27它9•泉州)水春牛森林植被茂盛,空气湿度大,年降雨量多.主要原因是植物的()A.吸收作用旺盛B 2021-02-03 …