早教吧作业答案频道 -->化学-->
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气20%NaOH
题目详情
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气
溶液
固体
NaNO2
已知:NO2+NO+2NaOH═2NaNO2+H2O
2NO2+2NaOH═NaNO2+NaNO3+H2O
2NaNO3
2NaNO2+O2↑
Ⅰ.(1)配制20%NaOH溶液,除烧杯、玻璃棒外,还需要的玻璃仪器有___(填仪器名称).
(2)操作①中,实验小组同学将气体通入盛有NaOH溶液的烧杯,部分同学认为存在缺陷,改用图1装置,玻璃管a的作用是___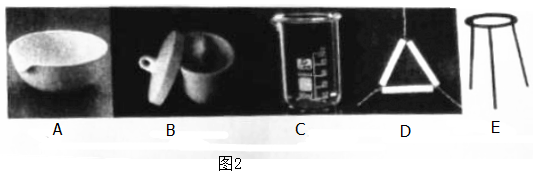
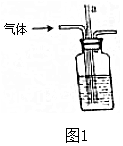
(3)操作③中会用到如图2中___仪器(填序号),
Ⅱ.NaNO2的性质
(4)设计一个实验验证酸性条件下NaNO2具有氧化性.___.
供选用的试剂:NaNO2溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液.
(5)酸性条件下NaNO2也具有还原性.取1.50g样品,配成100mL溶液.分别取出25.00mL,用0.1000mol•L-1 KmnO4酸性标准溶液滴定三次,测得平均消耗20.00mL KmnO4溶液.写出该反应的离子方程式___.滴定终点时的现象是___.NaNO2的纯度为___.
| 20%NaOH |
| |
| 操作① |
| 操作② |
| |
| 操作 |
| |
| ③ |
已知:NO2+NO+2NaOH═2NaNO2+H2O
2NO2+2NaOH═NaNO2+NaNO3+H2O
2NaNO3
| ||
Ⅰ.(1)配制20%NaOH溶液,除烧杯、玻璃棒外,还需要的玻璃仪器有___(填仪器名称).
(2)操作①中,实验小组同学将气体通入盛有NaOH溶液的烧杯,部分同学认为存在缺陷,改用图1装置,玻璃管a的作用是___

(3)操作③中会用到如图2中___仪器(填序号),
Ⅱ.NaNO2的性质
(4)设计一个实验验证酸性条件下NaNO2具有氧化性.___.
供选用的试剂:NaNO2溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液.
(5)酸性条件下NaNO2也具有还原性.取1.50g样品,配成100mL溶液.分别取出25.00mL,用0.1000mol•L-1 KmnO4酸性标准溶液滴定三次,测得平均消耗20.00mL KmnO4溶液.写出该反应的离子方程式___.滴定终点时的现象是___.NaNO2的纯度为___.

▼优质解答
答案和解析
I.(1)用固体氯化钠和水配制溶质质量分数为20%的氯化钠溶液的步骤为:计算、称量、量取、溶解、装瓶;
称量时用药匙取氯化钠固体,用托盘天平称量氯化钠固体;用量筒量、胶头滴管取所需水的体积;用烧杯溶解氯化钠,并用玻璃棒搅拌,所以需要的玻璃仪器有量筒、胶头滴管、烧杯、玻璃棒,配制20%NaOH溶液,除烧杯、玻璃棒外,还需要的玻璃仪器有量筒、胶头滴管,
故答案为:量筒、胶头滴管;
(2)操作中,实验小组同学将气体通入盛有NaOH溶液的烧杯,改用图1装置,玻璃管a的作用是保持容器内压强稳定,
故答案为:保持容器内压强稳定;
(3)操作③是高温分解硝酸钠固体,选择坩埚、泥三角、三脚架,
故答案为:BDE;
II.(4)说明 NO2-有氧化性,则N元素的化合价降低,在酸性条件下,与还原剂KI反应,所以选择的试剂为KI-淀粉溶液、稀硫酸,观察到溶液变蓝现象,证明其具有氧化性,
故答案为:取样,滴加稀硫酸和KI-淀粉溶液,若溶液变蓝,则证明 NO2-有氧化性;
(5 ) 酸性KMnO4溶液氧化亚硝酸根离子为硝酸根离子,高锰酸根离子被还原为锰离子,该反应的离子方程式为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;当加入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;
结合反应的离子方程式定量关系计算反应的亚硝酸钠,
2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
2 5
0.020L×0.1000mol•L-1 n
n=0.005mol
100.00ml溶液中NaNO2物质的量为0.005mol×4=0.02mol
得到混合物中质量分数=
×100%=92%;
故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;当加入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;92%.
称量时用药匙取氯化钠固体,用托盘天平称量氯化钠固体;用量筒量、胶头滴管取所需水的体积;用烧杯溶解氯化钠,并用玻璃棒搅拌,所以需要的玻璃仪器有量筒、胶头滴管、烧杯、玻璃棒,配制20%NaOH溶液,除烧杯、玻璃棒外,还需要的玻璃仪器有量筒、胶头滴管,
故答案为:量筒、胶头滴管;
(2)操作中,实验小组同学将气体通入盛有NaOH溶液的烧杯,改用图1装置,玻璃管a的作用是保持容器内压强稳定,
故答案为:保持容器内压强稳定;
(3)操作③是高温分解硝酸钠固体,选择坩埚、泥三角、三脚架,
故答案为:BDE;
II.(4)说明 NO2-有氧化性,则N元素的化合价降低,在酸性条件下,与还原剂KI反应,所以选择的试剂为KI-淀粉溶液、稀硫酸,观察到溶液变蓝现象,证明其具有氧化性,
故答案为:取样,滴加稀硫酸和KI-淀粉溶液,若溶液变蓝,则证明 NO2-有氧化性;
(5 ) 酸性KMnO4溶液氧化亚硝酸根离子为硝酸根离子,高锰酸根离子被还原为锰离子,该反应的离子方程式为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;当加入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;
结合反应的离子方程式定量关系计算反应的亚硝酸钠,
2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
2 5
0.020L×0.1000mol•L-1 n
n=0.005mol
100.00ml溶液中NaNO2物质的量为0.005mol×4=0.02mol
得到混合物中质量分数=
| 0.02mol×69g/mol |
| 1.5g |
故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;当加入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;92%.
看了 某实验小组设计如下流程,模拟...的网友还看了以下:
泡菜是常见的腌制食品,因含亚硝酸盐(如NaNO2)而引发人们的关注.根据要求回答问题:Ⅰ.腌制泡菜 2020-06-12 …
盐和盐反应要遵循什么规律盐和盐,盐和碱,盐和酸反应分别要遵循什么规律..所有的盐和盐都能反应吗?- 2020-06-28 …
一种盐水是用盐和水按3:50配制而成的.1.如果有30千克水,需要多少千克盐?2.用54千克盐一种 2020-07-09 …
按防疫部门规定,牛肉中亚硝酸盐(如亚硝酸钠)含量应小于30mg/kg,当人食用亚硝酸钠(NaNO2 2020-07-12 …
3、下列做法正确的是()A、用甲醛水溶液浸泡水产品以延长保鲜期B、用肥皂水区分硬水和软水C、服用氢 2020-07-15 …
据2009.3.15《今日视线》报道:近日,汕头市盐务局对多家餐饮店进行检查,发现不少商户购买私盐和 2020-11-12 …
2013年5月9日,宁波一家面馆误把亚硝酸钠(NaNO2)当成食盐和进面里,导致多人中毒.(1)Na 2020-11-14 …
近年来新闻媒介不断报导有人误将亚硝酸钠当食盐食用,发生中毒,甚至死亡事件.NaNO2在酸性介质中可以 2020-11-28 …
亚硝酸钠(NaNO2)是一种亚硝酸盐;如果食物中亚硝酸盐含量较高会引起食物中毒.其中毒症状是,1-3 2020-11-30 …
亚硝酸钠(NaNO2)的外观与食盐很相似,有咸味,误食能使人中毒.区别食盐和亚硝酸钠的一种方法是:将 2020-12-14 …