早教吧作业答案频道 -->化学-->
二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物
题目详情
二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图:
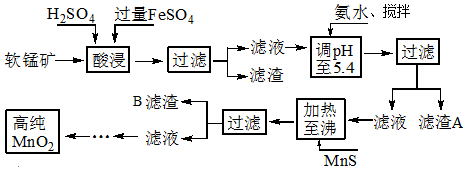
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为___.
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是___.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为___
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为___.

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是___.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为___
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为___.
▼优质解答
答案和解析
软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰,
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+,滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.4,恰好能使Fe3+、Al3+沉淀完全,
故答案为:充分氧化过量的Fe2+;5.4;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,滤渣B的成分是CuS、ZnS,
故答案为:CuS、ZnS;
(4)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O═MnO2+4H+;
(6)准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),
则得到:MnO2~I2~2S2O32-,
1 2
n 0.025.00L×0.0800mol•L-1×
n=0.005mol,
计算可得该样品MnO2纯度=
×100%=94.6%,
故答案为:94.6%;
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+,滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.4,恰好能使Fe3+、Al3+沉淀完全,
故答案为:充分氧化过量的Fe2+;5.4;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,滤渣B的成分是CuS、ZnS,
故答案为:CuS、ZnS;
(4)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O═MnO2+4H+;
(6)准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),
则得到:MnO2~I2~2S2O32-,
1 2
n 0.025.00L×0.0800mol•L-1×
| 100ml |
| 20ml |
n=0.005mol,
计算可得该样品MnO2纯度=
| 0.005mol×87g/mol |
| 0.4600g |
故答案为:94.6%;
看了 二氧化锰是制造锌锰干电池的基...的网友还看了以下:
三个人每人出10元钱住店,店长说优惠只收25,让伙计退回5元钱,半路伙计贪了2元,给三个人每人退了 2020-04-07 …
外币是十元的,左上角有个双头鹰,一面是两幅名建筑画(1、大桥2、宝塔楼房类似的),另一面是大坝. 2020-05-16 …
被评估企业拥有另一企业发行的面值共80万元的非上市普通股票,从持股期间来看,每年股利分 2020-05-19 …
A车与B车相撞,同时撞伤一行人丙,A车共5座,驾驶员和乘客座位均投保了每座5万元的车上人员责任险 2020-05-22 …
2013年春节期间,商城展开购物促销活动,凡购物总额超过2000元以上的部分可以享受七五折优惠.小 2020-06-04 …
48.81元的产品,买家需要27件,满199元优惠20元48.81元的产品,买家需要27件,现在有 2020-06-06 …
逻辑思维错误的题3个人去住旅馆,每人交了10元,店老板一共优惠了5元,老板把钱交给店小二,店小二从 2020-06-18 …
三人一起住旅馆,一间房30元,每人凑10元.老板说优惠5元,收25元,让伙计拿5元去还给三人.贪心 2020-06-20 …
2005年1美元兑换8.27元人民币,现在人民币对美元增值18%,现在1美元兑换人民币多少元?8. 2020-06-28 …
一道数学题.甲乙丙三人住旅店,一晚30元,三个人每人掏了10元,店主只要了25元,其于5元,要伙计 2020-07-15 …