早教吧作业答案频道 -->化学-->
I:(1)第三周期元素M的电离能情况如甲图A所示.则M元素的价层电子排布式是(2)图B折线(选填“a”、“b”或“c”)可以表达出第ⅣA族元素氢化物的沸点的变化规律.其中点A表示
题目详情
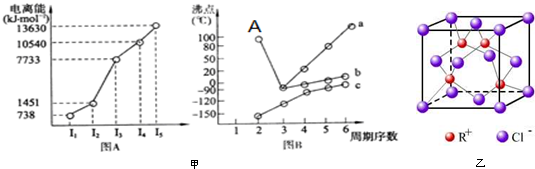
I:(1)第三周期元素M的电离能情况如甲图A所示.则M元素的价层电子排布式是___
(2)图B折线___(选填“a”、“b”或“c”)可以表达出第ⅣA族元素氢化物的沸点的变化规律.其中点A表示的分子的化学式为___,其沸点较高是因为___.
(3)COCl2 俗称光气,分子中C原子采取___杂化成键;其中分子中的共价键含有___(填序号):
A 2个σ键 1个π键 B 2个键π C 3个σ键、1个π键
Ⅱ:海水中富含氯元素.
(4)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为___
(5)下列是IA族的Li、Na、K三种金属元素的电离能
| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
(6)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图乙所示.R的元素符号是___,每个Cl-周围最近的Cl-___个.已知该晶体密度为1.15 g/cm3,则晶胞中最近的R+和Cl-之间的距离为___(NA=6.02×1023/mol,只写出计算表达式即可)
▼优质解答
答案和解析
I(1)第三周期元素M的第三电离能剧增,说明最外层电子数为2,故M为Mg,价层电子排布式是:3s2,
故答案为:3s2;
(2)第ⅣA族元素氢化物为分子晶体,分子之间不存在氢键,相对分子质量越大,沸点越高,故折线c表示第ⅣA族元素氢化物沸点;氢化物A的沸点为100℃,则A为水,由于水分子之间形成氢键,其沸点比较高,
故答案为:c;H2O;水分子间可以形成氢键;
(3)COCl2的结构式为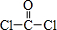 ,分子中C原子杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键.分子中含有3个σ键、1个π键,
,分子中C原子杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键.分子中含有3个σ键、1个π键,
故答案为:sp2;C;
Ⅱ(4)Cl-离子核外电子数为18,核外电子排布式为1s22s22p63s23p6,
故答案为:1s22s22p63s23p6;
(5)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,故离子半径X>Y>Z,则晶格能LiCl>NaCl>KCl,故熔点LiCl>NaCl>KCl,
故答案为:LiCl>NaCl>KCl;随核电荷数增大,阳离子半径增大,晶格能减小,熔点降低;
(6)R+中所有电子正好充满K、L、M 三个电子层,则R原子核外电子数为2+8+18+1=29,故R为Cu;
以顶点Cl-研究,与之最近的Cl-处于面心,每个顶点为8个晶胞共用,每个面心为两个晶胞共用,故每个Cl-周围最近的Cl- 有
=12个;
晶胞中最近的R+和Cl-处于体对角线上,距离为体对角线长的
,晶胞中有4个Cu+,Cl-离子数目为8×
+6×
=4,故晶胞质量为
g,该晶体密度为1.15 g/cm3,则晶胞体积为
g÷1.15 g/cm3=
cm3,故晶胞棱长为
cm,R+和Cl-距离=
×
cm,
故答案为:Cu;12;
×
故答案为:3s2;
(2)第ⅣA族元素氢化物为分子晶体,分子之间不存在氢键,相对分子质量越大,沸点越高,故折线c表示第ⅣA族元素氢化物沸点;氢化物A的沸点为100℃,则A为水,由于水分子之间形成氢键,其沸点比较高,
故答案为:c;H2O;水分子间可以形成氢键;
(3)COCl2的结构式为
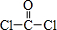 ,分子中C原子杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键.分子中含有3个σ键、1个π键,
,分子中C原子杂化轨道数目为3,C原子采取sp2杂化,单键为σ键,双键含有1个σ键、1个π键.分子中含有3个σ键、1个π键,故答案为:sp2;C;
Ⅱ(4)Cl-离子核外电子数为18,核外电子排布式为1s22s22p63s23p6,
故答案为:1s22s22p63s23p6;
(5)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,故离子半径X>Y>Z,则晶格能LiCl>NaCl>KCl,故熔点LiCl>NaCl>KCl,
故答案为:LiCl>NaCl>KCl;随核电荷数增大,阳离子半径增大,晶格能减小,熔点降低;
(6)R+中所有电子正好充满K、L、M 三个电子层,则R原子核外电子数为2+8+18+1=29,故R为Cu;
以顶点Cl-研究,与之最近的Cl-处于面心,每个顶点为8个晶胞共用,每个面心为两个晶胞共用,故每个Cl-周围最近的Cl- 有
| 8×3 |
| 2 |
晶胞中最近的R+和Cl-处于体对角线上,距离为体对角线长的
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| 4×99.5 |
| 6.02×1023 |
| 4×99.5 |
| 6.02×1023 |
| 4×99.5 |
| 1.15×6.02×1023 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
故答案为:Cu;12;
| ||
| 4 |
| 3 |
| ||
作业帮用户
2017-05-05
|
看了 I:(1)第三周期元素M的电...的网友还看了以下:
乙酸俗称醋酸,是家庭厨房里常用的调味料.醋酸分子式为CH3COOH,是一种电解质(填“强”或“弱” 2020-04-11 …
物理电能公式中,电功率所有换算公式(求原因),所有情况(串联和并联)及解析,P=IU,这个公式,还 2020-05-13 …
在电解饱和食盐水时,与电池正极相连的电极上所发生反应的电极反应式为:与电源负极相连的电极附近,溶液 2020-05-14 …
某手机充电宝的结构简图如图.它可以通过三种形式充电:USB充电、太阳能板充电和通过手摇发电装置充电 2020-07-19 …
物理电学公式的解析,即该公式的白话表达意思是什么?内容见详情、谢谢例如:欧姆定律I=U/R.就是电压 2020-11-21 …
1.生活中难免会遇到一些危急情况或意外伤害,下列急救措施不得当的是()A.遇到触电或溺水者,心跳、呼 2020-11-22 …
关于短路断路的问题.在电路图中在并联电路中短路怎么样断路又会发生什么状况?(电流表、电压表的情况)或 2020-11-26 …
1.生活中难免会遇到一些危急情况或意外伤害,下列急救措施不得当的是()A.遇到触电或溺水者,心跳、呼 2020-12-19 …
行列式的展开用行列式的行或者列展开解行列式这个方法具体在什么情况下使用?人大版跟同级版书上都没有写在 2020-12-24 …
()的电阻首尾依次相连,中间无分支的联结方式叫电阻的串联A两个或两个以上B两个C两个以上D()的电阻 2021-01-12 …
 扫描下载二维码
扫描下载二维码