早教吧作业答案频道 -->化学-->
铜冶金技术以火法冶炼为主.(1)火法炼铜的工艺流程如下:反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1①
题目详情
铜冶金技术以火法冶炼为主.
(1)火法炼铜的工艺流程如下:

反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1
①在反应Ⅱ中,每生成1mol SO2转移电子___mol.
②反应Cu2S(s)+O2(g)═2Cu(s)+SO2(g)的△H=___ kJ•mol-1.
③理论上m1:m2=___.
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品.
①制硫酸中重要的一步反应是
2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1.
图表示将2.0mol SO 2 和1.0mol O 2 置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度.
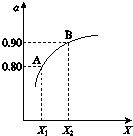
X代表的物理量是___.A对应条件下平衡常数K=___.
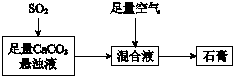
②下图表示的是生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO 2发生反应的原因___.
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取m g工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用c mol•L-1 I2标准溶液滴定,消耗的I2标准溶液V mL,工业硫酸中含有SO2的质量分数的计算式是___.
(1)火法炼铜的工艺流程如下:

反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1
①在反应Ⅱ中,每生成1mol SO2转移电子___mol.
②反应Cu2S(s)+O2(g)═2Cu(s)+SO2(g)的△H=___ kJ•mol-1.
③理论上m1:m2=___.
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品.
①制硫酸中重要的一步反应是
2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1.
图表示将2.0mol SO 2 和1.0mol O 2 置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度.

X代表的物理量是___.A对应条件下平衡常数K=___.
②下图表示的是生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO 2发生反应的原因___.

(3)工业硫酸中往往含有一定量SO2,测定过程如下:取m g工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用c mol•L-1 I2标准溶液滴定,消耗的I2标准溶液V mL,工业硫酸中含有SO2的质量分数的计算式是___.
▼优质解答
答案和解析
(1)①2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g),硫由-2价变成+4价,所以生成1mol的二氧化硫转移6mol的电子,故答案为:6;
②根据盖斯定律,反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,Cu2S(s)+O2(g)═2Cu(s)+SO2(g)的△H=
=
=-217.4kJ•mol-1,故答案为:-217.4;
③由反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g),反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)可知,反应Ⅰ生成2mol的氧化亚铜消耗2molCu2S,而2mol的氧化亚铜反应Ⅱ中消耗1mol的硫化亚铜,所以理论上m1:m2=2:1,故答案为:2:1;
(2)①2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1,正反应是放热反应,所以升高温度平衡逆向移动,SO2(g)的平衡转化率α减小,而增大压强平衡正向移动,SO2(g)的平衡转化率α增大,所以X代表的物理量是压强;反应达平衡后,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO2(g)+O2(g)⇌2SO3(g)
开始(mol):2 1 0
变化(mol):1.6 0.8 1.6
平衡(mol):0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.4mol/L,c(O2)=0.2mol/L,c(SO3)=1.6mol/L,故平衡常数k=
=80,故答案为:压强;80;
②碳酸钙的悬浊液中存在溶解平衡,所以而通入二氧化硫与水反应生成亚硫酸酸性比碳酸的酸性强,所以CaCO3悬浊液中存在CaCO3(s)⇌Ca2+(aq)+CO32-(aq),通入SO2时,CO32- 与SO2反应,c(CO32-)减小,溶解平衡正向移动,故答案为:CaCO3悬浊液中存在CaCO3(s)⇌Ca2+(aq)+CO32-(aq),通入SO2时,CO32- 与SO2反应,c(CO32-)减小,溶解平衡正向移动;
(3)根据反应SO2 +I2 +2H2O=H2SO4+2HI,
1mol 1mol
n(SO2) cV×10-3
所以 n(SO2)=cV×10-3mol,则SO2的质量分数的计算式:
×100%=
×100%,故答案为:
×100%.
②根据盖斯定律,反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,Cu2S(s)+O2(g)═2Cu(s)+SO2(g)的△H=
| △HⅠ+△HⅡ |
| 3 |
| 116-768.2 |
| 3 |
③由反应Ⅰ:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g),反应Ⅱ:2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)可知,反应Ⅰ生成2mol的氧化亚铜消耗2molCu2S,而2mol的氧化亚铜反应Ⅱ中消耗1mol的硫化亚铜,所以理论上m1:m2=2:1,故答案为:2:1;
(2)①2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1,正反应是放热反应,所以升高温度平衡逆向移动,SO2(g)的平衡转化率α减小,而增大压强平衡正向移动,SO2(g)的平衡转化率α增大,所以X代表的物理量是压强;反应达平衡后,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO2(g)+O2(g)⇌2SO3(g)
开始(mol):2 1 0
变化(mol):1.6 0.8 1.6
平衡(mol):0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.4mol/L,c(O2)=0.2mol/L,c(SO3)=1.6mol/L,故平衡常数k=
| 1.62 |
| 0.42×0.2 |
②碳酸钙的悬浊液中存在溶解平衡,所以而通入二氧化硫与水反应生成亚硫酸酸性比碳酸的酸性强,所以CaCO3悬浊液中存在CaCO3(s)⇌Ca2+(aq)+CO32-(aq),通入SO2时,CO32- 与SO2反应,c(CO32-)减小,溶解平衡正向移动,故答案为:CaCO3悬浊液中存在CaCO3(s)⇌Ca2+(aq)+CO32-(aq),通入SO2时,CO32- 与SO2反应,c(CO32-)减小,溶解平衡正向移动;
(3)根据反应SO2 +I2 +2H2O=H2SO4+2HI,
1mol 1mol
n(SO2) cV×10-3
所以 n(SO2)=cV×10-3mol,则SO2的质量分数的计算式:
cV×10-3mol×64g/mol×
| ||
| mg |
| 8cV |
| 25m |
| 8cV |
| 25m |
看了 铜冶金技术以火法冶炼为主.(...的网友还看了以下:
1.工人用一批铜制造若干台机器零件.如果每台机器用铜15.2千克,这批铜余下460克.经过改进,每 2020-04-07 …
急:请帮我算一下铜管的重量铜管材质是纯铜(紫铜)密度8.92/平方厘米 规格:外径:2.9cm 内 2020-05-17 …
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流 2020-06-26 …
这些A是怎么算的?例如:1.5平方毫米铜线——22A;2.5平方毫米铜线——30A500V及以下铜 2020-07-05 …
火法炼铜Cu2S+O2=高温=2Cu+SO2氧化剂还原剂是什么Cu2S有升有降,o2降了,这怎么算 2020-07-10 …
硫化亚铜与一定浓度的硝酸反应硫化亚铜(Cu2S)与一定浓度的硝酸反应,生成硝酸铜,硫酸铜,二氧化氮, 2020-11-05 …
硫化亚铜(Cu2S)铜元素与硫元素的质量比是多少. 2020-11-05 …
“大铜马”是为了纪念新四军在盐城重建军部,它的塑身由青铜(Cu、Sn合金)所铸。小红为了探究纯铜与青 2020-11-12 …
几道初2物理题,急啊!1.选择下列有关铜的说法中,错误的是()A.常温下的铜一定是固态的B.在一定条 2020-11-16 …
找一根5厘米长的铜片或粗铜丝,再从废干电池上剪下一条2毫米宽的锌皮,刮净,把铜丝和锌皮插入苹果或别的 2020-12-13 …