早教吧作业答案频道 -->化学-->
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)⇌2NH3(g)△H.(1)已知每破坏1mol有关化学键需要的能量如表:H-HN-HN-N
题目详情
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)⇌2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
则△H=___.
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将___(填“增大”“减小”或“不变”)
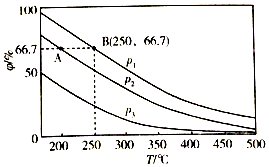
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是___,其原因是___.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=___(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)⇌2NH3(g)+CO2(g),能说明该反应达到平衡状态的是___(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.

(1)已知每破坏1mol有关化学键需要的能量如表:
| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将___(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是___,其原因是___.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=___(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)⇌2NH3(g)+CO2(g),能说明该反应达到平衡状态的是___(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
▼优质解答
答案和解析
(1)N2 (g)+3H2 (g)⇌2NH3(g)△H=反应物键能和-生成物键能和=945.8KJ/mol+3×435.9KJ/mol-6×390.8KJ/mol=-91.3KJ/mol,
故答案为:-91.3KJ/mol;
(2)保持恒温恒压,达到平衡后,再向容器中充入适量氨气,在恒压条件下与原平衡状态相同,为等效平衡,平衡时两种情况平衡状态相同,各物质的含量不变,所以达到新平衡时,c(H2)将不变,
故答案为:不变;
(3)①由N2+3H2⇌2NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为P1>P2>P3,因此压强关系是P1>P2>P3,
故答案为:p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;
②温度越大,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,
故答案为:<;
③N2+3H2⇌2NH3
开始 0.1 0.3 0
转化 x 3x 2x
平衡 0.1-x 0.3-3x 2x
=0.667,x=0.08
K=
=
=5925.9L2/mol2,
故答案为:5925.9L2/mol2;
(4)H2NCOONH4(s)⇌2NH3(g)+CO2(g),
①该反应为气体体积增大的反应,反应过程中压强逐渐增大,当压强不变时,表明正逆反应速率相等,该反应达到平衡状态,故①正确;
②由于H2NCOONH4是固体,没有达到平衡状态前,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故②正确;
③由于H2NCOONH4是固体,生成物全部为气体,气体的物质的量在增加,当混合气体的总物质的量不变,说明正逆反应速率相等,达到了平衡状态,故③正确;
④混合气体的平均相对分子质量=
,混合气体的质量恒等于H2NCOONH4(s)分解的质量,气体的物质的量为分解的H2NCOONH4(s)的三倍,混合气体的平均相对分子质量不变恒不变,不能说明反应达到平衡状态,故④错误;
⑤因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,故⑤错误;
故答案为:①②③.
故答案为:-91.3KJ/mol;
(2)保持恒温恒压,达到平衡后,再向容器中充入适量氨气,在恒压条件下与原平衡状态相同,为等效平衡,平衡时两种情况平衡状态相同,各物质的含量不变,所以达到新平衡时,c(H2)将不变,
故答案为:不变;
(3)①由N2+3H2⇌2NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为P1>P2>P3,因此压强关系是P1>P2>P3,
故答案为:p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;
②温度越大,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,
故答案为:<;
③N2+3H2⇌2NH3
开始 0.1 0.3 0
转化 x 3x 2x
平衡 0.1-x 0.3-3x 2x
| 2x |
| 0.1-x+0.3-3x+2x |
K=
| C2(NH3) |
| C(N2)×C3(H2) |
| 0.16×0.16 |
| 0.02×(0.06)3 |
故答案为:5925.9L2/mol2;
(4)H2NCOONH4(s)⇌2NH3(g)+CO2(g),
①该反应为气体体积增大的反应,反应过程中压强逐渐增大,当压强不变时,表明正逆反应速率相等,该反应达到平衡状态,故①正确;
②由于H2NCOONH4是固体,没有达到平衡状态前,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故②正确;
③由于H2NCOONH4是固体,生成物全部为气体,气体的物质的量在增加,当混合气体的总物质的量不变,说明正逆反应速率相等,达到了平衡状态,故③正确;
④混合气体的平均相对分子质量=
| 混合气体的质量总和 |
| 混合气体的物质的量总和 |
⑤因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,故⑤错误;
故答案为:①②③.
看了 氮的固定一直是科学家研究的重...的网友还看了以下:
关于古诺模型的一道计算题古诺市场上寡头有n个,按固定边际成本C生产,需求曲线p=a-Q,Q为行为总产 2020-03-30 …
如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的 2020-06-21 …
下列说法正确的是()A.甲烷是最简单的烷烃,其含碳量最高B.烷烃完全燃烧时,生成CO2和H2O的物 2020-07-21 …
1.莫高窟是怎样被破坏的?2.孙膑和孙武是什么关系?他们各写过一本什么书?3.词语填空.()栏远眺 2020-07-28 …
如图表示一定质量的氯酸钾和二氧化锰固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( 2020-07-29 …
如图所示,在M、N两点固定了两个带电量相等的正点电荷,O为M和N连线的中点,在其连线的中垂线上有两 2020-08-01 …
如图表示一定质量的高锰酸钾固体受热过程中,某变量y随时间的变化趋势,纵坐标表示的是()A.生成氧气的 2020-11-01 …
证;证件(n.)安全;安生性(n.)冒烟;吸烟(v.);烟(n.)兼职的(adj.)极小的;微小的( 2020-11-11 …
固体粉末甲由FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中的若干种组成 2020-11-24 …
在稀氨水中分别加入下列物质:A、浓氨水;B、水;C、少量Na2CO3固体;D、少量浓H2SO4;E、 2021-02-01 …